题目内容
【题目】实验室用锌和稀硫酸反应制取氢气的化学方程式为:Zn + H2SO4 == ZnSO4 + H2 ↑
要制取0.6克氢气,需要锌多少克________?如果反应后所得到的ZnSO4溶液质量为200克,计算所得到的ZnSO4溶液的溶质质量分数是多少?________(保留一位小数)
【答案】19.5克24.2%
【解析】
解:设要制取0.6克氢气,需要锌的质量为x,生成硫酸锌的质量为y
Zn + H2SO4 == ZnSO4 + H2 ↑
65 161 2
x y 0.6克
65/x=2/ 0.6克 x=19.5克
161/x=2/ 0.6g y=48.3g
溶液中溶质的质量分数=![]() ×100%,
×100%,
所以ZnSO4溶液的溶质质量分数=![]() ×100%≈24.2%
×100%≈24.2%
答:略

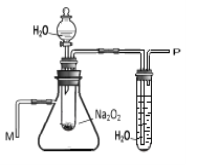
【题目】在元旦联欢晚会上,化学老师表演了“滴水生火”的魔术。先用棉花将淡黄色的过氧化钠(Na2O2)固体包在其中,然后将少量水滴到棉花上,棉花团剧烈燃烧起来。
同学们感到很惊讶,于是展开探究。
【提出问题】棉花为什么会发生燃烧?
【猜想与假设】
①过氧化钠与水反应生成氢氧化钠、氧气。
②过氧化钠与水反应生成氢氧化钠和________气。
③过氧化钠与水反应放出大量热。
【设计并实验】同学们利用右图所示装置进行了如下探究。
编 号 | 主要实验操作 | 实验现象 | 实验结论 |
打开装置中分液漏斗的活塞,滴加适量水后,关闭活塞。 | |||
将带火星的木条接近P处 | B瓶中有气泡产生;带 火星的木条复燃 | _________ | |
③ | _________ | _________ | 过氧化钠与水反应放 出大量热 |
【解释与结论】
(1)同学们设计实验时,增加了防止发生爆炸的装置B,其原因是_________。
(2)经测定,过氧化钠与水反应还有氢氧化钠生成,该反应的化学方程式为________。
(3)将少量水滴到包有Na2O2固体的棉花上,棉花团剧烈燃烧起来的原因是_________。
【题目】下图是一个具有刻度和活塞可滑动的玻璃容器,其中有空气和足量的白磷,将它放在盛有沸水的烧杯上方,进行实验。请完成实验报告:
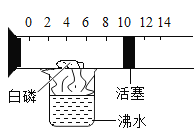
实验目的 | 实验现象 | 实验结论 |
测定空气中氧气的体积分数。 | 白磷着火燃烧,活塞先______移,后_____移,最后停在刻度约为______(填整数)的位置上。 | 空气的成分按体积计算,氧气约占____。 |
