题目内容
【题目】(5分)A~G表示初中化学常见的物质,它们之间的转化关系如图所示(部分生成物已略去),其中A为金属氧化物,E、F为金属单质,且F为紫红色,化学反应②和③的基本反应类型相同。
请按要求填空:
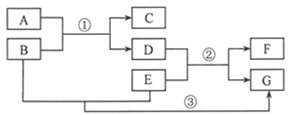
(1)物质C的化学式为 。
(2)写出反应②的一个化学方程式 。
(3)反应③的基本反应类型是 。
(4)E、F和氢由强到弱的金属活动性顺序为 (填元素符号)。
【答案】(1)H2O (2)Fe+CuSO4==Cu+FeSO4
(3)置换反应 (4)Fe H Cu
【解析】
试题分析:(1)A为金属氧化物,那么B是一种酸,因为D可以和金属单质E反应生成紫红色的金属单质F,所以可以判断C为水;F为紫红色金属,则F为铜,D就是硫酸铜,
(2)根据(1)的分析可知E可以把金属铜从它的盐溶液中置换出来,所以E是比铜活泼的金属,可以定为铁,所以反应为:Fe+CuSO4==Cu+FeSO4
(3)反应③是酸与金属的反应,是置换反应
(4)F为铜,E是比铜活泼的金属,并且能够和酸反应,所以应该在氢前,所以由强到弱的金属活动性顺序为:Fe H Cu

练习册系列答案
相关题目