题目内容
【题目】(12分)将1.5 g混有铜粉的镁粉投入100g11.76%的稀硫酸中,至不再产生气泡为止,共收集0.1 g气体。过滤后,向所得溶液滴入质量分数为10%的氢氧化钠溶液。开始滴入时无沉淀生成,滴加一定质量的氢氧化钠溶液后开始出现白色沉淀。当滴加氢氧化钠溶液的质量为80g时,恰好得到最多的沉淀量2.9 g。试求:
(1)原混合物中镁的质量分数;
(2)最终所得溶液中溶质的质量分数。(计算结果保留至0.01%)
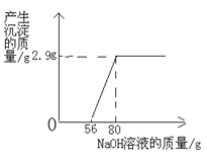
(3)请画出平面直角坐标图:要求以氢氧化钠溶液的质量为横坐标,产生沉淀的质量为纵坐标,并且标示出起点、折点的坐标
【答案】(1)80% (2)7.97%
【解析】
试题分析:镁与硫酸反应生成硫酸镁和氢气,利用化学方程式,根据氢气与镁反应的质量比即可计算出金属镁的质量;
解:(1)设原混合物中镁的质量为x,
则Mg+H2SO4=MgSO4+H2↑
24 2
x 0.1 g
24:x=2:0.1g
x=1.2g,
Mg%=1.2g/1.5g ×100%=80%
(2)加入的氢氧化钠溶液先与溶液中的硫酸反应,将硫酸完全反应后氢氧化钠再与硫酸镁反应生成氢氧化镁沉淀和氢氧化镁沉淀。 H2SO4+2NaOH=Na2SO4+2H2O,MgSO4+2NaOH=Na2SO4+Mg(OH)2↓ ,根据反应的化学方程式可知,NaOH全部转化为Na2SO4 ,根据转化关系即可计算出溶质硫酸钠的质量;
设最终所得Na2SO4的质量为y,
2NaOH ~ Na2SO4
80 142
80 g×10% y
80: (80 g×10%)=142:y
y=14.2g
根据质量守恒定律,反应所得溶液质量=100 g+80 g+1.2 g—0.1 g—2.9 g=178.2g
硫酸钠溶液中溶质的质量分数= 14.2g/178.2g×100%==7.97%
(3)根据题意,当滴加氢氧化钠溶液的质量为80g时,恰好得到最多的沉淀量2.9 g,即氢氧化钠与硫酸、硫酸镁前后反应的氢氧化钠的质量为80g,生成的氢氧化镁沉淀的质量为2.9g。利用化学方程式可计算出与硫酸反应的氢氧化钠溶液的质量为56g。

 阅读快车系列答案
阅读快车系列答案【题目】(9分)现有下列装置,回答问题:
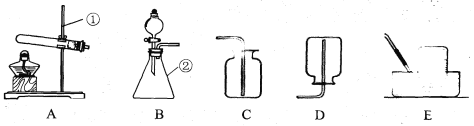
(1)写出有标号仪器的名称:① ,② ;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为 ,发生装置为 (填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有 (写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
【实验内容】:
编号 | 实验内容 | 实验现象 | 实验结论 |
1 | 取反应后固体剩余物0.2g 加入5mL6%的 | 剧烈反应,放热 产生大量气泡 | 生成物中的 催化分解 |
2 | 取0.2g ( | 平稳反应,放热,持续产生气泡 |
分解 |
3 | 取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸 上无黑色固体残余物 | 固体剩余物中无 |
【实验分析】:
①完善上表中的填空内容:实验2 、实验3 ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
【资料】:在43.9℃~377.9℃范围中,![]() span>受热分解时,会发生以下两个反应:
span>受热分解时,会发生以下两个反应:
![]()
④取8.0g![]() ,加热使之完全分解,生成
,加热使之完全分解,生成![]() 的质量可能为 (填字母序号);
的质量可能为 (填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,![]() 在43.9℃一377.9℃范围中的失重率(
在43.9℃一377.9℃范围中的失重率(![]() 与
与![]() 的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,
的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,![]() 分解反应主要以 (填“a”或“b”)为主。
分解反应主要以 (填“a”或“b”)为主。