题目内容
【题目】(15分)碳酸钠、碳酸氢钠是中学常见的化合物。
探究一:碳酸钠、碳酸氢钠与酸反应
如图所示,将两气球内的NaHCO3和Na2CO3同时倒入试管中。已知盐酸足量,且装置气密性良好。
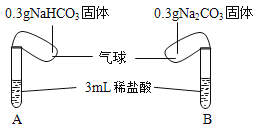
回答下列问题:
(1)碳酸钠俗名是 。
(2)实验过程中观察到的现象是: 。
(3)NaHCO3和Na2CO3都能与盐酸反应产生二氧化碳、水和氯化钠。任写出其中一个反应的化学方程式 。
(4)已知NaHCO3、Na2CO3的相对分子质量分别为84、106,通过计算:实验结束后, (填“A”或“B”)试管的气球更大。
探究二:碳酸氢钠、碳酸钠固体与酸反应的热效应
【发现问题】在探究一实验过程中用手触摸试管,发现盛NaHCO3的试管温度降低,而盛Na2CO3的试管温度升高。
【猜想与推测】甲同学由此推测:NaHCO3和盐酸反应为吸热反应,Na2CO3和盐酸反应为放热反应。
【实验与数据】乙同学认为甲同学推测不妥,通过以下多次实验后取平均值数据记录如下:
步骤① | 步骤② | 步骤③ | 步骤④ | 步骤⑤ |
测量10mL水温/℃ | 加入物质0.5 g | 溶解后测量溶液温度t1/℃ | 静置一段时间后测量溶液温度t2/℃ | 加入20%盐酸10 mL反应后测量溶液温度t3/℃ |
20 | NaHCO3 | 18.5 | 20.0 | 20.8 |
20 | Na2CO3 | 23.3 | 20.0 | 23.7 |
【分析与结论】
(1)由步骤①~③比较得到的结论是 。
(2)由步骤④~⑤比较得到的结论是: 。
(3)结合上面探究活动,你认为甲同学推测的不妥之处是 。
【答案】探究一:(1)纯碱(苏打)(2分)
(2)固体溶解、气泡产生,气球胀大(2分)
(3)Na2CO3+2HCl==2NaCl+H2O+CO2↑(或NaHCO3+HCl==NaCl+H2O+CO2↑) (3分)
(4)A (2分)
探究二:(1)Na2CO3溶于水放热,而NaHCO3溶于水吸热(只答对一点即可得分)(2分)
(2)Na2CO3溶液、NaHCO3溶液与稀盐酸反应都是放热(只答对一点得1分)(2分)
(3)判断固体与溶液反应的能量变化需综合考虑物质溶解过程的能量变化及反应过程的能量变化。(2分)
【解析】
试题分析:(1)碳酸钠俗名是纯碱或苏打;(2)固体逐渐溶解,产生气泡,气球胀大;(3)化学方程式为:Na2CO3+2HCl==2NaCl+H2O+CO2↑(或NaHCO3+HCl==NaCl+H2O+CO2↑)(4)【分析与结论】
(1)由步骤①~③比较得到的结论是Na2CO3溶于水放热,而NaHCO3溶于水吸热(2)由步骤④~⑤比较得到的结论是Na2CO3溶液、NaHCO3溶液与稀盐酸反应都是放热(3)判断固体与溶液物质反应的能量变化需综合考虑物质溶解过程的能量变化及反应过程的能量变化。