题目内容
【题目】(4分)金属和金属材料在生活和生产中有着广泛的应用。请回答下列问题:
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属. 的位置移到最后,正好符合由弱到强的金属活动性顺序。
(2)钢铁容易生锈而造成损失,生锈后如不及时处理则会加速生锈,试写出用稀硫酸除铁锈的化学方程式 。
(3)小明为了验证铝、银、铜三种金属的活动性顺序,设计了三个实验:①将Al、Cu分别放入稀盐酸中;②将Ag放入Cu(NO3)2溶液中;③将Al放入AgNO3溶液中。其中不必进行的实验是 。
(4)在![]() 、
、![]() 和
和![]() 的混合溶液中,加入一定量的铁粉充分反应后,过滤、洗涤,将残渣放入盐酸中有气泡产生,滤液中存在的阳离子是 。
的混合溶液中,加入一定量的铁粉充分反应后,过滤、洗涤,将残渣放入盐酸中有气泡产生,滤液中存在的阳离子是 。
【答案】(1)铁 (2)Fe2O3+3H2SO4==Fe2(SO4)3+3H2O (3)③ (4)K+、Fe2+
【解析】
试题分析:(1)常见金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au,在“五金:金、银、铜、铁、锡”顺序中把金属铁的位置移到最后,正好符合由弱到强的金属活动性顺序
(2)IE学的主要成分是氧化铁,用稀硫酸除铁锈的化学方程式:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
(3)实验①将Al、Cu分别放入稀盐酸中,可以证明Al的活动性大于Cu;实验②将Ag放入Cu(NO3)2溶液中,可以证明Cu的活动性大于Ag;即将Al、Cu、Ag三种金属的活动性强弱比较出来了,故实验③不必进行
(4)在AgNO3、KNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,根据金属的活动强弱以及金属与混合盐溶液反应的原则:“弱者先出局”,故先后反应以下2个反应:2AgNO3+Fe==Fe(NO3)2+2Ag ,Cu(NO3)2+ Fe==Fe(NO3)2+ Cu ,反应结束后在残渣放入盐酸中有气泡产生,说明铁有剩余,则AgNO3和Cu(NO3)2全部被反应完全,故滤液中存在的阳离子是K+、Fe2+

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
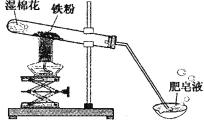
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为_________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是___________________________。