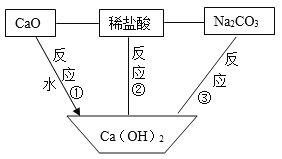
��Ŀ����
����Ŀ��ij��ȤС��ͬѧ��ʵ�������һƿƿ��û�иǺõĹ����������ƣ���С��һ���������ƿҩƷ�Ƿ���ʽ���̽��������������һ���������̽�����
���������ϣ�Na2CO3�׳ƴ�����մ�����Һ�ʼ��ԡ�
���Թ�����룩
�����ȫ����NaOH�������ȫ����Na2CO3���������NaOH��Na2CO3����
��ʵ����ƶϣ�
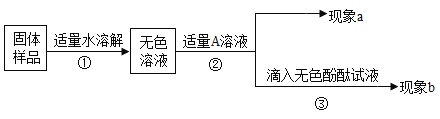
(1)������aΪ�����ݲ�����������A��Һ��____��˵�����������Ѿ����ʣ���������������ݲ����ķ�Ӧ�Ļ�ѧ����ʽ��_____��
(2)��A�dz����ʯ��ˮ������a�а�ɫ����������bΪ��ɫ��̪��Һ���ɫ�������ɰ�ɫ����Ϊ___(�ѧʽ)�������ҷ��ָ�ʵ�鲻��˵����Ʒ�к���NaOH��
(3)��A��CaCl2��Һ����ʵ������aΪ��ɫ����������bΪ____�������������
����˼����չ���پ��õ��������Ʊ��ʵ�ԭ���û�ѧ����ʽ��ʾΪ____��
�������������Dz��ֱ��ʣ�����ѡ�õij�ȥ�����Լ���____��
���𰸡�ϡ���� Na2CO3+2HCl=2NaCl+CO2��+H2O CaCO3 ��ɫ��̪�����ɫ CO2+2NaOH=Na2CO3+H2O Ca(OH)2��Һ��Ba(OH)2��Һ
��������
��1������Һ�еμ�ϡ���ᣬ������̼���Ʒ�Ӧ�������Ȼ��ơ�ˮ�Ͷ�����̼���۲쵽�����ݲ�����˵�����������Ѿ����ʣ�
��2������Һ�еμ�����������Һ������������̼���Ʒ�Ӧ������̼��Ƴ������������ƣ����ڷ�Ӧ�������������ƣ���˵����̪��첻��˵��ԭ����Һ�к����������ƣ�
��3������Һ�еμ��Ȼ��ƣ��Ȼ�����̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ��ٵ���ķ�̪��Һ����죬˵����Һ�в����������ƣ����ж�ԭ����ȫ��Ϊ̼���ƣ��ʲ���II������
[��˼����չ]���������ƿ������ն�����̼����Ӧ������̼���ƺ�ˮ��ʹ�������Ʊ��ʣ�
���������Ʋ��ֱ�������̼���ƣ��ɼ��������������ƻ�����������Һ����Ϊ̼���ƺ��������ƻ�����������Һ��Ӧ�������������ƺ�̼��ƻ�̼�ᱵ���������˼��ɵõ�����������Һ��
�ʴ�Ϊ��
��1�����Na2CO3+2HCl=2NaCl+H2O+CO2����
��2��CaCO3��
��3����ɫ��̪�����ɫ��
[��˼����չ]CO2+2NaOH=Na2CO3+H2O��Ca(OH)2��Һ��Ba(OH)2��Һ��

 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д� ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�����Ŀ�����ࡢ�����ѧϰ��ѧ���õķ�����������Щ����������ѧ��ѧϰ��ѧ֪ʶ��
��1�����л�ѧ������ʵ�飬������ʵ����ҪĿ�Ŀɽ�ʵ���Ϊ��̽�����ʷ�����ѧ��Ӧǰ��������ϵ��̽�����ʵ����ʣ�̽�����ʵĺ����ȡ��ݴ�Ӧ������ʵ���е�D��_______���A����B����C������Ϊһ�࣬������_____��
|
|
|
|
A | B | C | D |
��2���ٵ�����Ϊ 10 �����Ӻܶ࣬���а���������������������һЩ���ӡ��뽫���ʵĻ�ѧ��������հ�HF��H2O��_____��CH4��Ne��
�ڲ������ϵ�֪Mg��Mn��Fe��Cu���ֽ������˳���ǣ�����ǿ������������ʵ����֤������ۣ�����ͨ�����������û���Ӧ��֤�� ����������Ӧ�Ļ�ѧ����ʽΪ:A.![]() ��B.
��B.![]() ���������������Ӧ�Ļ�ѧ����ʽ����д��ȱ�ٵ�һ����Ӧ�Ļ�ѧ����ʽΪ_____��
���������������Ӧ�Ļ�ѧ����ʽ����д��ȱ�ٵ�һ����Ӧ�Ļ�ѧ����ʽΪ_____��