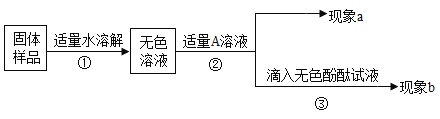
题目内容
【题目】如图所示,在托盘天平两盘上各放一只质量相同的烧杯,分别注入 200g 质量分数为 7.3%的稀盐酸,天平平衡。向左盘烧杯中加入 8g 某碳酸钙和氧化钙组成的固体混合物,其钙元素质量分数为 50%,充分反应。下列有关说法中,正确的是( )

A.理论上,左盘烧杯中可生成 2.4g 气体
B.充分反应后,左盘烧杯溶液中含有两种溶质
C.向右盘烧杯中加入 5.6g 铁粉,天平能够重新平衡
D.向右盘烧杯中加入 5.6g 质量分数为 1.7%的硝酸银溶液, 天平能够重新平衡
【答案】B
【解析】
盐酸的质量为200g×7.3%=14.6g;
设碳酸钙的质量为m,则
![]() ,解得m=2.7g;
,解得m=2.7g;
设2.7g碳酸钙和稀盐酸反应生成二氧化碳质量为x,此过程碳酸钙消耗的盐酸质量为y,则
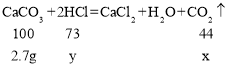
![]() ,解得x=1.2g,y=2g;
,解得x=1.2g,y=2g;
故左盘烧杯中可生成1.2g 气体;
设固体中氧化钙消耗盐酸的质量为z,则
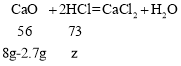
![]() ,解得z=6.9g;
,解得z=6.9g;
被消耗的盐酸的质量为2g+6.9g=8.9g<14.6g,盐酸有剩余,充分反应后,左盘烧杯溶液中含有两种溶质,盐酸和氯化钙;
左盘反应后质量为200g+8g-1.2g=206.8g,右盘加入5.6g铁,设可生成氢气的质量为n,则
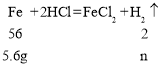
![]() ,解得n=0.2g;
,解得n=0.2g;
右盘反应后质量为200g+5.6g-0.2g=205.4g,小于左盘反应后质量,加入5.6g铁不能使天平平衡;
向右盘烧杯中加入 5.6g 质量分数为 1.7%的硝酸银溶液,也能使天平平衡;
综上所述,选项B说法正确。
故选:B。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】为测定石灰石中碳酸钙的质量分数,小明取石灰石样品,加到足量的稀盐酸中,进行实验(假定样品中其他成分不与稀盐酸反应)。
石灰石样品的质量 | 烧杯和稀盐酸的总质量 | 反应后烧杯及烧杯中各物质的总质量 |
12.5g | 87.5g | 95.6g |
请计算:
(1)生成二氧化碳的质量______________。
(2)求样品中碳酸钙的质量分数________________(写出计算过程)