题目内容
【题目】化学实验技能是学习化学和进行探究活动的基础和保证。以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究:
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等;猜想2:____________。
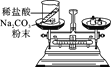
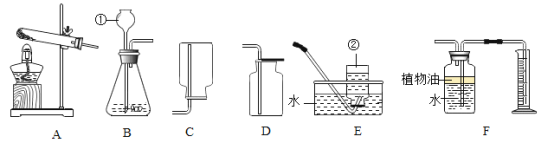
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案 (反应后略) |
|
|
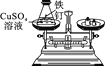
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面有红色物质析出,溶液由蓝色变为浅绿色,天平指针没有偏转 |
结论 | 猜想1正确 | 猜想2正确,反应的化学方程式:__________________________ |
(反思与评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在____________中进行。
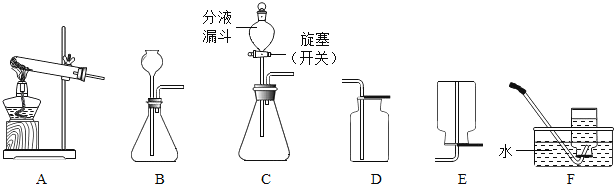
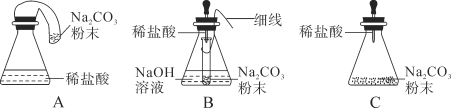
(优化装置)同学们对甲组左盘中的反应装置进行了如下三种改进,查阅资料后发现最佳装置是B,则猜想B中氢氧化钠具有的化学性质是__________________________。
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。
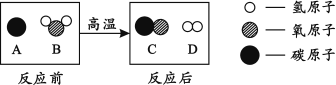
(解释与应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:硝酸铵(NH4NO3)固体在不同温度下发生不同的分解反应,则下列各物质可能是该反应产物的是________(填序号)。
A.NH3 B.H2O C.SO2 D.N2
【答案】相等 Fe+CuSO4=FeSO4+Cu 密闭容器 氢氧化钠能和二氧化碳发生反应 ABD
【解析】
[猜想与假设]
根据提出的问题,猜想质量相等或不相等,猜想二故填相等;
[实验探究]
铁和硫酸铜反应生成铜和硫酸亚铁,方程式故填Fe+CuSO4=FeSO4+Cu;
[反思与评价] 在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密闭容器中进行,故填密闭容器;
[优化装置]
碳酸钠粉末和盐酸剧烈反应生成二氧化碳气体,装置A中产生的二氧化碳充满气球,使整个装置所受空气浮力增大,影响天平平衡,装置C中反应太快,橡皮塞容易被冲开,装置B中利用氢氧化钠吸收生成的二氧化碳,实验效果最好,故填氢氧化钠能和二氧化碳发生反应;
[解释与应用]
可知硝酸铵中含有氮、氢、氧三种元素,根据质量守恒定律可知化学反应前后元素种类不变,可知硝酸铵固体在不同温度下发生不同的分解反应, 生成物中不可能有硫元素,故填ABD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案