题目内容
【题目】为测定某石灰石矿中碳酸钙的含量,现称取![]() 石灰石矿样品与100g稀盐酸恰好反应
石灰石矿样品与100g稀盐酸恰好反应![]() 杂质不溶于水,也不参与反应
杂质不溶于水,也不参与反应![]() ,反应后,剩余物质的质量为
,反应后,剩余物质的质量为![]() 。计算:
。计算:
![]() 反应生成的二氧化碳的质量为______g。
反应生成的二氧化碳的质量为______g。
![]() 计算该石灰石样品含
计算该石灰石样品含![]() 的质量分数_____?
的质量分数_____?
【答案】![]() 80%
80%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算该石灰石样品含CaCO3的质量分数。
解:(1)根据质量守恒定律可得,生成的二氧化碳的质量为12.5g+100g-108.1g=4.4g;
(2)设该石灰石样品含CaCO3的质量分数为x,
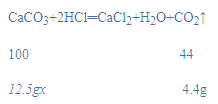
![]()
x=80%;
答:(1)反应生成的二氧化碳的质量为 4.4g;
(2)该石灰石样品含CaCO3的质量分数为80%。

【题目】化学实验技能是学习化学和进行探究活动的基础和保证。以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究:
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等;猜想2:____________。
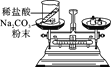
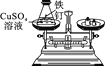
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案 (反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面有红色物质析出,溶液由蓝色变为浅绿色,天平指针没有偏转 |
结论 | 猜想1正确 | 猜想2正确,反应的化学方程式:__________________________ |
(反思与评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在____________中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下三种改进,查阅资料后发现最佳装置是B,则猜想B中氢氧化钠具有的化学性质是__________________________。
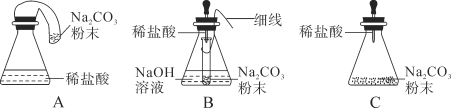
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。
(解释与应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:硝酸铵(NH4NO3)固体在不同温度下发生不同的分解反应,则下列各物质可能是该反应产物的是________(填序号)。
A.NH3 B.H2O C.SO2 D.N2
【题目】将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
下列判断正确的是( )
A. X是一氧化碳B. X一定是该反应的催化剂
C. X可能含有氢元素D. 表中a的值为2g