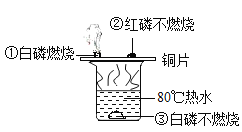
题目内容
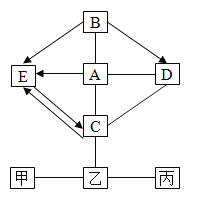
【题目】黄铜矿(主要成分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如下图所示:
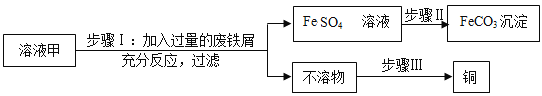
(1)Fe2(SO4)3与铁反应的化学方程式: x Fe2(SO4)3+ y Fe= z FeSO4,其中x、y、z为化学计量数,Z的值为_______。
(2)步骤1中,废铁屑要磨成粉末,这样做的目的_______,步骤1中,生成铜的化学方程式:_______。
(3)步骤II中加入种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是________(填化学式)。
【答案】3 增大反应的接触面积,使反应更充分 Fe+CuSO4=FeSO4+Cu Na2CO3
【解析】
(1)Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+y Fe═z FeSO4,根据质量守恒定律配平后为:Fe2(SO4)3+2 Fe═3 FeSO4,其中 x=1、y=2、z=3,所以z 的值为 3。
(2)废铁屑要磨成粉末,可以增大反应的接触面积,使反应更充分;溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4。
(3)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是可溶性碳酸盐碳酸钠(Na2CO3)。

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目