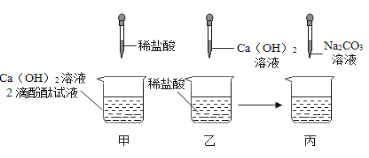
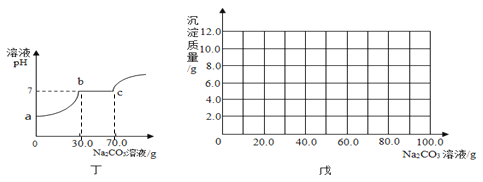
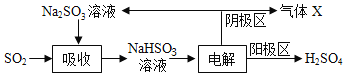
题目内容
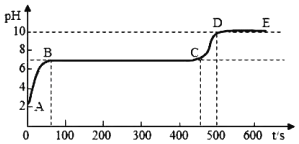
【题目】中和反应是一类重要的化学反应。某同学利用图 1 装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH 和温度传感器测量反应过程中相关物理量的变化情况,得到图 2 和图 3。
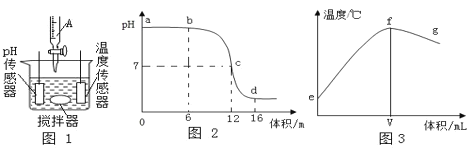
(1)烧杯中发生反应的化学方程式为____________。
(2)仪器 A 中溶液的溶质是____________(填化学式)。
(3)图 3 中 V 的数值最接近图 2 中的____________(填图 2 中横坐标中的数值,“6”、“12” 或“16”)。
(4)下列说法正确的是____________(填序号)。
A图 2 中 b 点所示溶液中的溶质是 NaCl 和 NaOH
B取图 2 中 d 点所示溶液加热蒸干所得固体为纯净物
C图 2 中 c→d 所示溶液中 NaCl 质量不断增加
D图 3 中 e→f 变化趋势说明该反应是放热反应
【答案】![]() HCl 12 ABD
HCl 12 ABD
【解析】
氢氧化钠和盐酸反应生成氯化钠和水。
(1)在烧杯中氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式为![]() 。
。
(2)由图2可知,开始溶液的pH大于7,最终溶液的pH小于7,则是将盐酸滴加到氢氧化钠溶液中,故仪器A中是盐酸溶液,溶质是HCl。
(3)由图2和图3的信息可知,该反应是放热反应,当二者恰好完全反应时,溶液的温度最高,此时溶液呈中性,pH=7,故图3中V的数值最接近12。
(4)A、在图2中b点所示溶液中pH>7溶液呈碱性,溶液中的溶质是NaCl和NaOH,故A正确;
B、图2中d点所示溶液中pH<7,溶液呈酸性,溶质是NaCl和HCl,氯化氢是气体在蒸发过得中挥发掉了,则所得固体为纯净物,故B正确;
C、图2中在c点盐酸和氢氧化钠恰好完全反应,c→d所示溶液中,氯化钠的质量不会增加,故C不正确;
D、图3中e→f变化趋势可说明该反应是放热反应,故D正确。故选ABD。

【题目】为测定一种含碳酸钙的“石头纸”中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品,分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
则求:(1)表中X的值为________;
(2)求样品中碳酸钙的质量分数________;
(3)烧杯④中物质充分反应后所得溶液的质量为____g。