题目内容
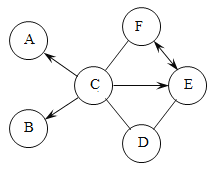
【题目】A为黑色固体,A、C、D、Y都是氧化物,E是单质,F、G为常见的物质,其中B、E、G属于单质,如图是它们之间的相互转化关系。请回答:
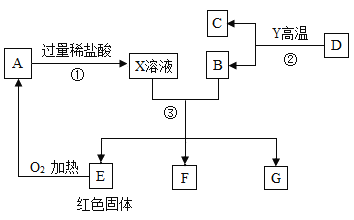
(1)写出下列物质的化学式:
A:_____ D:_____ Y:_____。
(2)X溶液中所含有的溶质为_____;F溶液所含有的溶质是_____。
(3)写出下列反应的化学方程式:反应③中生成无色气体的化学方程式_____。G和A在加热条件下发生的化学反应的化学方程式_____。
(4)D与Y的反应在_____方面有重要作用。
【答案】CuO Fe2O3 CO2 HCl、CuCl2 FeCl2 Fe+2HCl=FeCl2+H2↑ CuO+H2![]() Cu+H2O 炼铁
Cu+H2O 炼铁
【解析】
E是红色固体单质,E是铜,铜和氧气加热生成的A,A是氧化铜,A与过量的稀盐酸反应得到的X溶液中含有生成的氯化铜和剩余的盐酸,B能与X溶液反应生成铜和单质F、G,B是铁,F是氯化亚铁,G是氢气,D是氧化物和氧化物Y反应产生的C也是氧化物,D是氧化铁,Y是一氧化碳,C是二氧化碳。
(1)由分析可知,A是氧化铜, D是氧化铁,Y是一氧化碳,故化学式A是CuO;D是Fe2O3;Y是CO2。
(2)氧化铜与过量的稀盐酸反应得到的X溶液中含有生成的氯化铜和剩余的盐酸,故化学式为HCl、CuCl2;F溶液所含有的溶质是铁和盐酸反应产生的氯化亚铁,故化学式为 FeCl2。
(3)反应③是铁和过量的盐酸反应产生氯化亚铁和氢气,反应的化学方程式为Fe+2HCl=FeCl2+H2↑;物质G和A在加热条件下反应是氧化铜和氢气在加热的条件下生成铜和水,反应的化学方程式为CuO+H2![]() Cu+H2O。
Cu+H2O。
(4)D和Y反应是一氧化碳和氧化铁高温产生铁和二氧化碳,可以用于工业炼铁,故D与Y的反应在炼铁方面有重要作用。

【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量/g | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为________g
(2)该黄铜中铜的质量分数为多少_______?(写出计算过程)
(3)第三次实验后所得溶液的溶质为__________。
【题目】如图是A物质的溶解度曲线图,下表是B物质在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 |
B物质溶解度/g | 32 | 35 | 40 | 45 | 55 |

(1)请根据上表数据在图上绘制出B物质的溶解度曲线_____。
(2)_____℃时,A、B两种物质的饱和溶液中溶质的质量分数相等。
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法。你认为_____同学的方法合理。
(4)40℃时,要使240g A物质M点的溶液变成该温度下的饱和溶液,需要加A的质量为_____g。
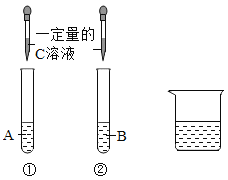
【题目】在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量关系,能用如图曲线表示的是( )
序号 | 甲 | 乙 |
① | HNO3溶液 | NaOH溶液 |
② | HCl溶液 | 石灰石粉末 |
③ | CaCl2溶液 | Na2CO3溶液 |
④ | H2SO4溶液 | 锌粒 |
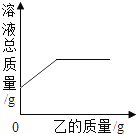
A. ①② B. ②④ C. ②③④ D. ①②④