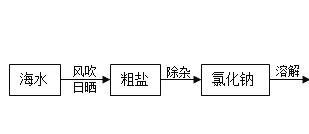
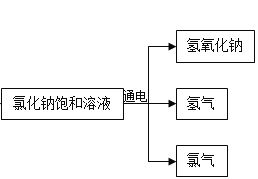
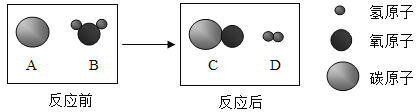
题目内容
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( )
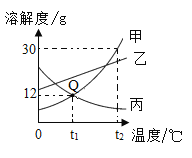
A.Q点表示t1℃时,甲、丙两种物质的溶解度相等
B.t2℃时,将30g甲物质加入到50g水中充分搅拌,得到80g甲的饱和溶液
C.将丙的饱和溶液变为不饱和溶液,可采用升温的方法
D.t1℃时甲、乙、丙三种物质的饱和溶液升高到t2℃时,溶质质量分数为甲>乙>丙
【答案】A
【解析】
A、通过分析溶解度曲线可知,Q点表示t1℃时,甲、丙两种物质的溶解度相等。A正确;
B、t2℃时,甲物质的溶解度是30g,含义是t2℃时,100g的水中,最多能溶解甲的质量为30g,所以在该温度下,50g水中最多能溶解甲15g,得到65g甲的饱和溶液。B错误;
C、丙物质的溶解度随温度的升高而减小,所以将丙的饱和溶液变为不饱和溶液,可采用降温的方法。C错误;
D、t1℃时,乙物质的溶解度大于甲物质的溶解度,则t1℃时乙的饱和溶液的溶质质量分数大于甲的饱和溶液的溶质质量分数。甲、乙、丙三种物质的饱和溶液升高到t2℃时,由于甲、乙的溶解度随温度的升高而增大,则甲、乙不会析出晶体,且溶质的质量分数也不会变。但是丙物质的溶解度随温度的升高而减小,所以升温后,丙物质会析出晶体,溶质质量分数也会减小。则升温后,溶质质量分数为乙>甲>丙。D错误。
故选A。

 名校课堂系列答案
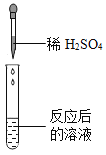
名校课堂系列答案【题目】某兴趣小组的同学将一定质量的碳酸氢钠和稀硫酸混合,充分反应,有气泡逸出。同学们对反应后溶液中溶质的成分进行了探究。
(猜想与假设)
猜想①:溶质成分是 _______________
猜想②:溶质成分是硫酸钠、碳酸氢钠
猜想③:溶质成分是硫酸钠、硫酸
(查阅资料)NaHCO3溶液呈碱性。
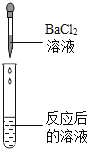
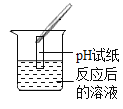
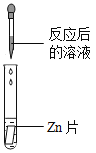
(实验药品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成下表。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
实验现象 | _______ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH<7 | __________ |
(得出结论)猜想③正确。
(评价反思)
(1)写出碳酸氢钠和稀硫酸反应的化学方程式_____________。
(2)上述实验中存在一处明显错误操作的是方案_______________(填字母序号)。
(3)有同学认为仅凭B实验方案中的实验现象,不能得出“猜想③”正确,其理由是 ____________。
(4)用上述药品,请你再设计一个不同的实验方案证明“猜想③”正确_______________。