题目内容
【题目】在厨房里蕴藏着许多化学知识。
(1)下列食物中,能提供大量维生素的是____________________(填字母)。

(2)加铁酱油中的“铁”是指________________________(填“元素“或“原子“),身体缺铁会引起______________________病症。
(3)厨房中能用来除水垢的物质是________________________ 。(从“纯碱”“食盐”“食醋”中选一种)
【答案】C 元素 贫血 食醋
【解析】
(1)牛奶中富含蛋白质;大米中富含糖类;蔬菜、水果中富含维生素;
(2)食品、药品、营养品、矿泉水等物质中的“碘、氟、钙、铁、锌”等不能以单质、分子、原子形式存在,而是指元素,故加铁酱油中的“铁”通常是指元素;身体缺铁会引起贫血病症。
(3)食醋的主要成分是醋酸,水垢的主要成分是碳酸钙,碳酸钙与醋酸反应,生成溶于水的物质;
故答案为:(1)C;(2)元素;贫血;(3)食醋。

【题目】某同学查阅资料得知,实验室常用电石(主要成分CaC2)与水反应制取乙炔(C2H2),反应的化学方程式为:CaC2+H2O=Ca(OH)2+ C2H2![]() (电石中的杂质不溶于水且不参与反应)。在实验室中,该同学把一定量的CaC2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
(电石中的杂质不溶于水且不参与反应)。在实验室中,该同学把一定量的CaC2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
[提出问题]:滤液中溶质的成分是什么?
[猜想与假设]:猜想一:NaOH、Na2CO3
猜想二:NaOH
猜想三:NaOH、__________(将猜想三补充完整)
[分析与推理]:
反应后滤液中一定存在的溶质是__________(填化学式,下同),可能存在的溶质是______和______。对可能存在的溶质,需进一步实验验证。
[设计并实验]:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,向其中加入过量稀盐酸 | 无气泡产生 | 猜想_____不成立 |
实验二 | 另取少量滤液于试管中,向其中滴入适量碳酸钠溶液 | _________________ | 猜想三成立,发生反应的化学方程式为_______ |
[拓展延伸]:
若向CuCl2溶液中加入少量CaC2,充分反应,可观察到有气泡产生,同时出现蓝色的沉淀。写出产生蓝色沉淀的这一步反应方程式 ________________________。实验室保存电石应注意______。
【题目】为研究物质的溶解现象进行了如下实验(20℃),现象如下图所示(水的密度为1 g/cm3):
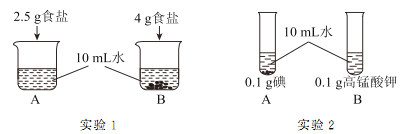
(1)实验1一定为饱和溶液的是_______(填序号)。
(2)实验2观察到碘几乎不溶解,高锰酸钾全部溶解,该实验可得出的结论是_______
(3)以下是氯化钠和高锰酸钾的溶解度表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
高锰酸钾 | 2.8 | 4.3 | 6.4 | 9.0 | 12.6 | 18.0 | 22.1 | |
将50℃的高锰酸钾饱和溶液和氯化钠的饱和溶液冷却到20℃时,氯化钠溶液的溶质质量分数____<填“>”“<”或“=”)高锰酸钾溶液的溶质质量分数。
【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。