题目内容
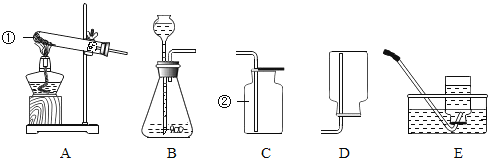
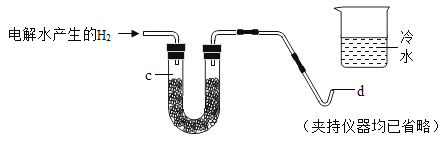
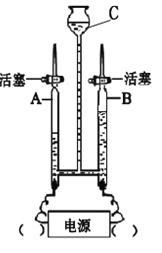
【题目】如图所示为实验室中常见气体的制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。某校两个化学兴趣小组的同学欲 用它们完成如下探究实验。
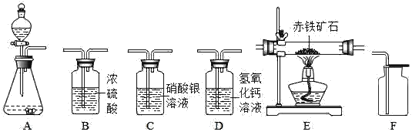
(1)第一组的同学以石灰石和稀盐酸为原料,制取并收集一瓶干燥、纯净的二 氧化碳气体,进行二氧化碳的性质实验。(盐酸有挥发性)
①实验室制取气体时,组装好仪器后,应先___________ 再添加药品。
②所选仪器的连接顺序为___________ (填写仪器序号字母)。
③生成二氧化碳时,所发生反应的化学方程式为:____________。
④若将少量 CO2 气体通入盛有大量澄清 Ca(OH)2 溶液的大烧杯中,烧杯中溶液的质量与之前相比会_______ (填“变大”、“变小”或“不变”)。
④灭火是二氧化碳的重要用途之一,二氧化碳能够扑灭木材着火的根本原因是下 列的___________(填写序号 A、B、C.D 之一)。
A 二氧化碳密度比空气大 B 二氧化碳降低了可燃物的着火点
C 二氧化碳能与水反应 D 二氧化碳既不能燃烧,也不支持燃烧
(2)第二组的同学欲用混有少量二氧化碳的一氧化碳气体,测定某赤铁矿石中 氧化铁的纯度(已知杂质不挥发也不发生反应)。所选仪器的连接顺序为:混合 气体→E→D。
①仪器 D 中看到的现象是__________。
②仪器 E 中发生反应的化学方程式为___________。
③若通过测量反应前、后 D 装置的质量变化,来计算赤铁矿石中氧化铁的纯度。 则计算出样品纯度的结果将___________(填“ 偏大” 偏小” 或“ 不影响” )。原因 是___________。
④已知装置 E 中赤铁矿石样品的质量为 10g,若充分反应后,E装置中剩余固体 质量为 8g,则该赤铁矿石中氧化铁的纯度为____________ (计算结果精确到 0.1%)。
【答案】检查装置的气密性 ACBF CaCO3+2HCl=CaCl2+H2O+CO2↑ 变小 AD 澄清的石灰水变浑浊 3CO+Fe2O3![]() 2Fe+3CO2 偏小 反 应生成的二氧化碳没有被完全吸收 66.7%
2Fe+3CO2 偏小 反 应生成的二氧化碳没有被完全吸收 66.7%
【解析】
解:(1)①制取二氧化碳气体之前要先检查装置的气密性,以防装置漏气影响实验结果;
②实验室用浓盐酸和石灰石制取的二氧化碳中混有氯化氢、水蒸气,硝酸银会与 盐酸反应,浓硫酸有吸水性,除去水蒸气需要放在最后,二氧化碳的密度比空气 大,所以所选仪器的连接顺序为 ACBF;
③ 碳 酸 钙 和 盐 酸 反 应 生 成 氯 化 钙 、 水 和 二 氧 化 碳 , 化 学 方 程 式 为 :
CaCO3+2HCl=CaCl2+H2O+CO2↑;
④由于二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,虽然有二氧化碳进入溶液,但生成的碳酸钙属于沉淀,不能算溶液质量,烧杯中溶液的质量与之前相比会减少;
⑤二氧化碳能够扑灭木材着火的根本原因是:密度比空气大,不能燃烧且不支持 燃烧;
(2)①二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,所以观察到装置 D 中澄清的石灰水变浑浊;
② 在 高 温 的 条 件 下 , 一 氧 化 碳 还 原 氧 化 铁 生 成 铁 和 二 氧 化 碳 ,化 学 方 程 式 为 :3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
③若通过测量反应前、后 D 装置的质量变化,氢氧化钙微溶,并不能将反应生成的二氧化碳完 全吸收,所以计算出的氧化铁质量偏小,则计算出样品纯度的结果将偏小;
④已知装置 E 中赤铁矿石样品的质量为 10g,若充分反应后,E 装置中剩余固体质量为 8g,质量减少了 10g﹣8g=2g,即氧化铁中氧元素的质量为 2g,则氧化铁的质量为:2g÷![]() 6.67g,则该赤铁矿石中氧化铁的纯度为
6.67g,则该赤铁矿石中氧化铁的纯度为![]() =66.7%。
=66.7%。

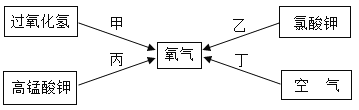
【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。
(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
(实验记录)同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.5g NaCl | 0.5g FeCl3 | ||||
60分内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定__________来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是__________(填序号)。
(4)通过实验①、②、④可得出的结论是_______________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是____________、____________(答两点)。
(6)你认为影响过氧化氢溶液分解速率的因素还有哪些?请设计实验验证你的猜想
(猜想假设)___________________。
(实验操作)___________________。
(实验结论)___________________。
【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ、(探究一)影响过氧化氢分解快慢的因素
分别取5mL过氧化氢溶液进行实验,测定产生4mL氧气所需时间,实验结果记录如下:
实验序号 | 过氧化氢溶液的浓度% | 温度℃ | 二氧化锰粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1________t2(填“>”、“=”或“<”)
(2)能说明过氧化氢分解快慢与过氧化氢溶液的浓度有关的两个实验是________(填实验序号),并且得出的结论是_____________。
交流探讨:二氧化锰属于金属氧化物,其它金属氧化物能否起到类似二氧化锰的催化作用?
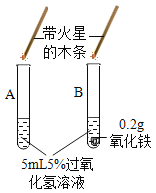
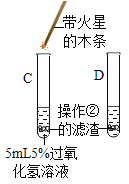
Ⅱ、(探究二)探究氧化铁是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B | 氧化铁________(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、称量。 | 固体质量为________ g | 氧化铁质量不变 |
③ |
| C试管上方带火星的木条________, D中溶液变成黄色 | 氧化铁可作过氧化氢分解的催化剂 |
【题目】人教版新课标化学教材九年级上册“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?(实验探究)
实验步骤 | 实验现象 |
Ⅰ 分别量取5ml5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
Ⅱ 待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | A试管中均能产生气泡,带火星木条均复燃 |
Ⅲ 将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | / |
Ⅳ 分别量取5ml5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | / |
(实验结论)
(1)A中产生的气体是______(填化学式)。
(2)实验Ⅱ、Ⅲ证明:氧化铁的______和质量在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)写出氧化铁催化过氧化氢分解的方程式______。
(实验评价)
(1)实验设计Ⅳ的目的是______。
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是______。