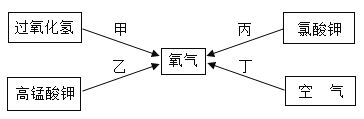
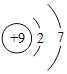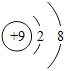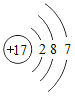题目内容
【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ、(探究一)影响过氧化氢分解快慢的因素
分别取5mL过氧化氢溶液进行实验,测定产生4mL氧气所需时间,实验结果记录如下:
实验序号 | 过氧化氢溶液的浓度% | 温度℃ | 二氧化锰粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1________t2(填“>”、“=”或“<”)
(2)能说明过氧化氢分解快慢与过氧化氢溶液的浓度有关的两个实验是________(填实验序号),并且得出的结论是_____________。
交流探讨:二氧化锰属于金属氧化物,其它金属氧化物能否起到类似二氧化锰的催化作用?
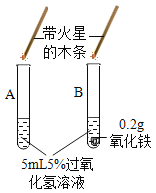
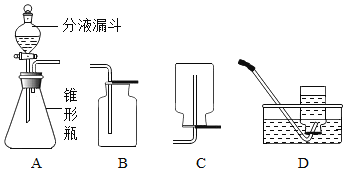
Ⅱ、(探究二)探究氧化铁是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B | 氧化铁________(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、称量。 | 固体质量为________ g | 氧化铁质量不变 |
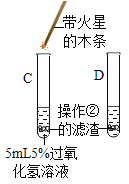
③ |
| C试管上方带火星的木条________, D中溶液变成黄色 | 氧化铁可作过氧化氢分解的催化剂 |
【答案】> ③④ 在其它条件相同情况下,过氧化氢溶液浓度越大,过氧化氢分解越快 加快 0.2 复燃
【解析】
Ⅰ.(1)对比①②可知,其他条件均相同,②实验温度较高,过氧化氢分解较快,因此t2所需时间较短;
(2)③④两组实验唯一的不同是过氧化氢溶液浓度,因此能得出过氧化氢分解快慢与浓度有关;能得出的合理结论是:其他条件相同时,H2O2溶液的浓度数越大,过氧化氢分解越快;
Ⅱ.①AB两组实验唯一区别是B组实验加了氧化铁,结果A试管上方带火星的木条未复燃,B中出现气泡快带火星的木条复燃,由此能得出Fe2O3加快过氧化氢分解;
②由于实验得出的结论是Fe2O3质量不变,还是0.2g;
③因为Fe2O3可作过氧化氢分解的催化剂,所以其化学性质未变,仍可以使带火星木条复燃。

【题目】请回答:如图是元素周期表中的一部分,请回答下列问题.
第一周期 |
|
| ||||||
第二周期 |
|
|
| ① |
|
|
|
|
第三周期 |
|
|
|
|
|
| ② |
|
(1)表中,①所示元素的名称是_______,②所示元素组成的单质的化学式_______;
(2)![]() 与Ne的核外电子排布相同,则X的元素符号为_______,它处在元素周期表中第_______周期,它与氧元素组成的化合物的化学式为_______.
与Ne的核外电子排布相同,则X的元素符号为_______,它处在元素周期表中第_______周期,它与氧元素组成的化合物的化学式为_______.