��Ŀ����
����Ŀ���±���Ԫ�����ڱ��е�2��3���ڵ�Ԫ�أ���ش��й����⡣
2 | 3 Li � 6.941 | 4 Be �� 9.012 | 5 B �� 10.81 | 6 C ̼ 12.01 | 7 N �� 14.01 | 8 O �� 16.00 | 9 F �� 19.00 | 10 Ne �� 20.18 |
3 | 11 Na �� 22.99 | 12 Mg þ 24.31 | 13 Al �� 26.98 | 14 Si �� 28.09 | 15 P �� 30.97 | 16 S �� 32.06 | 17 Cl �� 35.45 | 18 Ar � 39.95 |
��1�����и���������ƻ�ѧ���ʵ�Ԫ����________________������ĸ��ţ���
A. Na��Cl B.O��S C. F��Cl D. Cl��Ar
��2��д��һ����������Ԫ��ԭ�ӵĺ�������Ų�����______________________________________________��
��3����7��Ԫ�����12��Ԫ�ص�ԭ���γɻ�����Ļ�ѧʽΪ_____________��
��4��������ͬԭ�����͵������ķ��ӻ����ӽеȵ����壬�ȵ�����������ƵĽṹ�����ʡ����и������������ڵȵ�������________________������ĸ��ţ���
A.NO��O2 B.CO��N2 C.SO2��CO2 D.PO43��SO42
���𰸡�BC ����������ӻ��������������������������� Mg3N2 BD
��������
��1��Ԫ��������������ͬ���仯ѧ�������ƣ���Ԫ�����ڱ���ͬһ����Ϊͬһ���Ԫ�أ����ǵ���������������ͬ�������⣬��Ϊֻ��һ����ӣ�������Ϊ2��ʱ��Ϊ�ȶ��ṹ������O��S ��F��Cl��ѧ�������ƣ�ѡBC��
��2��ԭ�ӽṹ�е��Ӳ�������Ԫ���������������Ҵ������������������������ӡ��ʵ�������Ԫ��ԭ�ӵĺ�������Ų�����Ϊ����������ӻ������������������ӣ�
��3����7��Ԫ��ΪN��������������Ϊ5����3�����ӳ�ΪN3-����12��Ԫ����Mg��������������Ϊ2����ʧȥ2�����ӳ�ΪMg2+���������γɻ�����Ļ�ѧʽΪMg3N2��
��4�����ݾ�����ͬԭ�����͵������ķ��ӻ����ӽеȵ�������з�����
A��NO�е�����Ϊ7+8=15��O2�е�����Ϊ8+8=16������ԭ�Ӹ�����ȣ�������������ȣ����������⣻
B��CO�е�����Ϊ6+8=14��N2�е�����Ϊ7+7=14������ԭ�����͵���������ȣ��������⣻
C��SO2�е�����Ϊ16+8+8=32��CO2�е�����Ϊ6+8+8=22������ԭ������ȣ�������������ȣ����������⣻
D��PO43-�е�����Ϊ15+4![]() 8+3=50�� SO42�е�����Ϊ16+4
8+3=50�� SO42�е�����Ϊ16+4![]() 8+2=50 ������ԭ�����͵���������ȣ��������⡣
8+2=50 ������ԭ�����͵���������ȣ��������⡣
��ѡBD��

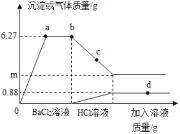
����Ŀ��Ϊ��̽���кͷ�Ӧ���ס�������ͬѧ�ֱ���������֧�Թ��еμ�ϡ���ᡣ
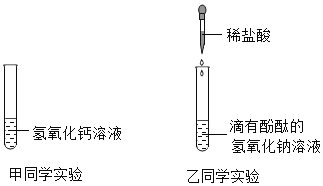
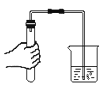
(1)��ͬѧ����з�̪������������Һ������ϡ����,�ߵμӱ�����ͬѧ���ⷢ�������ݲ�����˵��������������Һ�ѱ���,���ʵ�ԭ��_________________________________ (�û�ѧ����ʽ��ʾ).
(2)��ͬѧΪ�˼��������������Һ�ı��ʳ̶ȣ����ʵ�鷽�����ó����ۡ�
ʵ����� | ʵ������ | ʵ����� |
ȡ���������Թ��У��ȵμ�_________���ٵμ�_________ | ____________ | ����������Һ���ֱ��� |
(3)ʵ������ס���ͬѧ�����������Թ��еķ�Һ����ͬһ�ྻ�ձ��У��õ���ɫ������Һ������������Һ�����ʵijɷ�Ϊ��_______________����_____________________(�����Ƿ�̪)��
(4)��ͬѧҪ��ȥ���ֱ��ʵ�����������Һ�е����ʣ���ѡ��������_________.
A. ����������Һ B. ���ᱵ��Һ C. ����������Һ D. �Ȼ�����Һ��