题目内容
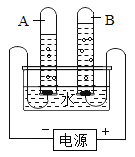
【题目】请结合图示实验装置,回答下列问题.
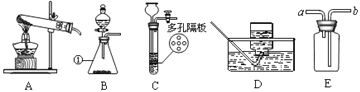
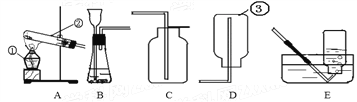
(1)写出标号①的仪器名称:_____.
(2)用高锰酸钾制氧气选用的发生装置是_____(选填序号),反应的化学方程式为_____.
(3)若B装置中固体为二氧化锰,分液漏斗中加入过氧化氢溶液可制氧气.因为在此反应发生过程中,二氧化锰加快了反应的速度,而且反应前后二氧化锰的_____保持不变,所以在此过程中二氧化锰是一种_____.若用D装置收集氧气,当导管口有气泡_____时才能将导管伸入集气瓶中.
(4)实验室可用B或C装置制二氧化碳,反应的化学方程式为_____,C相对于B装置的优点有_____.若用E装置收集二氧化碳,气体应从_____端通入(选填“a”或“b”).
(5)已知二氧化碳是一种可溶性气体,常温常压下1体积气体的水最多可以溶解1体积的二氧化碳,这个溶解度在可溶性气体中是最小的.请你对采用D装置,用排水法收集二氧化碳,做出一个全面综合的评价_____.
【答案】锥形瓶 A 2KMnO4![]() K2MnO4+MnO2+O2↑ 质量和化学性质 催化剂 连续均匀冒出 CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以控制反应的发生和停止 b 因为二氧化碳能溶于水但溶解量较小,二氧化碳与水生成的碳酸又易分解,因此二氧化碳在实际实验操作中可以用排水法收集
K2MnO4+MnO2+O2↑ 质量和化学性质 催化剂 连续均匀冒出 CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以控制反应的发生和停止 b 因为二氧化碳能溶于水但溶解量较小,二氧化碳与水生成的碳酸又易分解,因此二氧化碳在实际实验操作中可以用排水法收集
【解析】
高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,双氧水在二氧化锰催化作用下生成水和氧气,二氧化碳与水生成的碳酸。
(1)标号①的仪器名称是锥形瓶。
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,故发生装置为A,反应的化学方程式为2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
(3)如果用双氧水和二氧化锰制氧气就不需要加热,其中二氧化锰是催化剂,其质量和化学性质在反应前后不变;用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时。
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,不需要加热,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;C装置的优点是可以控制反应的发生和停止;若用E装置收集二氧化碳,气体应从长管进入,二氧化碳的密度比空气大,故从b管通入。
(5)对采用D装置,用排水法收集二氧化碳,做出一个全面综合的评价:二氧化碳能溶于水但溶解量不大,二氧化碳与水生成的碳酸又易分解,二氧化碳在实际实验操作中可以用排水法收集。

【题目】下表是元素周期表中第2、3周期的元素,请回答有关问题。
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)下列各组具有相似化学性质的元素是________________(填字母序号);
A. Na、Cl B.O、S C. F、Cl D. Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律______________________________________________;
(3)第7号元素与第12号元素的原子形成化合物的化学式为_____________;
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体是________________(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43和SO42