题目内容
【题目】为了探究中和反应,甲、乙两名同学分别向下列两支试管中滴加稀盐酸。
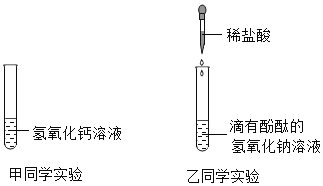
(1)乙同学向滴有酚酞的氢氧化钠溶液中逐渐加入稀盐酸,边滴加边振荡,乙同学意外发现有气泡产生,说明该氢氧化钠溶液已变质,变质的原因_________________________________ (用化学方程式表示).
(2)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
实验操作 | 实验现象 | 实验结论 |
取样少许于试管中,先滴加_________,再滴加_________ | ____________ | 氢氧化钠溶液部分变质 |
(3)实验结束后,甲、乙同学将他们两人试管中的废液倒入同一洁净烧杯中,得到无色澄清溶液,分析所得溶液中溶质的成分为①_______________,②_____________________(不考虑酚酞)。
(4)丙同学要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的_________.
A. 氢氧化钡溶液 B. 硝酸钡溶液 C. 氢氧化钙溶液 D. 氯化钠溶液。
【答案】![]() 足量CaCl2溶液或BaCl2溶液 酚酞溶液 先有沉淀产生,加入酚酞后溶液变红 NaCl、CaCl2 NaCl、CaCl2、HCl AC
足量CaCl2溶液或BaCl2溶液 酚酞溶液 先有沉淀产生,加入酚酞后溶液变红 NaCl、CaCl2 NaCl、CaCl2、HCl AC
【解析】
根据氢氧化钠的变质主要是与空气中的二氧化碳反应生成碳酸钠,故对其变质的检验即为对碳酸钠的检验。
(1)乙同学向滴有酚酞的氢氧化钠溶液中逐渐加入稀盐酸,发现有气泡产生,说明该氢氧化钠溶液已变质,即氢氧化钠溶液中含有碳酸钠,故其反应方程式为![]() ;
;
(2)乙同学为了检验该氢氧化钠溶液的变质程度,既要对碳酸钠进行检验又要对氢氧化钠进行检验,而碳酸钠溶液显碱性,会对氢氧化钠的检验造成干扰,故应该先加足量CaCl2溶液或BaCl2溶液对碳酸钠进行检验并除去,再向溶液中滴加酚酞检查溶液是否显碱性来确定是否还含有氢氧化钠;若氢氧化钠完全变质,则实验现象为有沉淀产生,加入酚酞后无变化;若氢氧化钠部分变质,则实验现象为有沉淀产生,加入酚酞后溶液变红;
故表格中填写如下:
实验操作 | 实验现象 | 实验结论 |
取样少许于试管中,先滴加足量CaCl2溶液或BaCl2溶液,再滴加_酚酞溶液_ | 先有沉淀产生,加入酚酞后溶液变红 | 氢氧化钠溶液部分变质 |
(3)实验结束后,甲、乙同学将他们两人试管中的废液倒入同一洁净烧杯中,得到无色澄清溶液,溶液不显碱性,则甲中Ca(OH)2一定反应完而HCl可能反应完也可能没有反应完;①若HCl反应完则溶液中的溶质为NaCl、CaCl2;②若HCl没有反应完则溶液中的溶质为NaCl、CaCl2、HCl ;
(4)氢氧化钡溶液和氢氧化钙溶液都可除去部分变质的氢氧化钠溶液中的碳酸钠杂质,故应该选AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表中第2、3周期的元素,请回答有关问题。
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)下列各组具有相似化学性质的元素是________________(填字母序号);
A. Na、Cl B.O、S C. F、Cl D. Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律______________________________________________;
(3)第7号元素与第12号元素的原子形成化合物的化学式为_____________;
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体是________________(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43和SO42