题目内容
【题目】请写出下列反应的化学方程式,并注明反应的类型(化合、分解、置换、复分解).
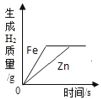
(1)铝和氧气的反应 ,反应类型 ,
(2)实验室用锌和稀盐酸制取氢气 ,反应类型 .
【答案】(1)4Al+3O2![]() 2Al2O3;化合反应;(2)Zn+2HCl═ZnCl2+H2↑;置换反应
2Al2O3;化合反应;(2)Zn+2HCl═ZnCl2+H2↑;置换反应
【解析】
本题难度不大,掌握化学方程式的书写方法、四种基本反应类型的特征是正确解答本题的关键。(1)铝和氧气在点燃条件下生成氧化铝,反应的化学方程式为:4Al+3O2![]() 2Al2O3,该反应符合“多变一”的特征,属于化合反应;(2)锌和稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。
2Al2O3,该反应符合“多变一”的特征,属于化合反应;(2)锌和稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。

 阅读快车系列答案
阅读快车系列答案【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质
【题目】某化学兴趣小组在实验室里进行电解水实验。
(基础实验)如图所示,在电解器玻璃管里加满水(水中加入少量氢氧化钠),接通直流电源,一段时间后断开电源。用燃着的木条分别在两个玻璃管尖嘴口检验电解反应中产生的气体。

(1)打开管a活塞,观察到_________________。
(2)该实验说明水是由__________________组成的。
(3)电解水的反应属于基本反应类型中的___________。请从分子、原子的角度,分析该反应的实质:_______________。
(提出问题)理论上电解水生成氢气与氧气的体积比为2︰1,实际测定结果却往往大于2︰1。这是为什么?
(查阅资料)常温常压下,1L水中最多能溶解约31mL氧气、18mL氢气。
(探究实验)分别选用不同的电极材料进行电解水实验,3分钟后记录实验数据如下表:
电极材料 | 铜丝 | 铁丝 | 保险丝 | 电阻丝 |
氢气与氧气的体积比 | 7.7︰3.3 | 6.5︰3.2 | 6.9︰2.9 | 7.3︰3.4 |
(实验分析)下列关于电解水实验的说法中,正确的是____________(填字母)。
A水中加入少量氢氧化钠以增强导电性
B铜丝作为电极时,测得的氢气与氧气的体积比最接近2︰1
C选用不同的电极材料进行实验,可能影响测得的气体体积比
D氢气与氧气在水中溶解能力不同,可能影响测得的气体体积比
(拓展延伸)该小组同学用氯化钠代替氢氧化钠加入水中进行电解水实验,结果发现管a中收集到的气体呈黄绿色,已知该气体是一种单质,请完成发生反应的化学方程式:2NaCl+2H2O![]() H2↑+__________。
H2↑+__________。
【题目】下表是元素周期表中第2、3周期的元素,请回答有关问题。
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)下列各组具有相似化学性质的元素是________________(填字母序号);
A. Na、Cl B.O、S C. F、Cl D. Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律______________________________________________;
(3)第7号元素与第12号元素的原子形成化合物的化学式为_____________;
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体是________________(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43和SO42