题目内容
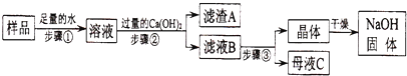
【题目】海水素有“液体工业原料”之美誉。工业“从海水中提取镁”的主要流程如图:
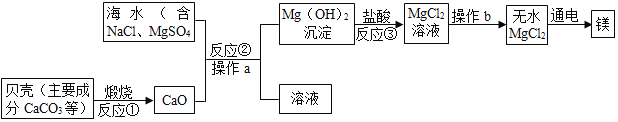
(1)反应①煅烧过程中生成的另一种氧化物是_____(填物质名称)。
(2)操作b的名称是_____,操作a、b中都要用到一种玻璃仪器该仪器在操作a中的作用是_____。
(3)以上提取镁的全过程中没有涉及的化学反应类型是_____(填基本反应类型),写出反应③的化学方程式:_____。
(4)该反应生产生石灰的主要原料来源于海洋中的贝壳,优点是_____。
【答案】二氧化碳 蒸发 引流 置换反应 Mg(OH)2+2HCl=MgCl2+2H2O 充分利用海洋化学资源、节约成本,提高经济效益
【解析】
(1)贝壳的主要成分是碳酸钙,高温煅烧时产生氧化钙和二氧化碳,故填:二氧化碳;
(2)蒸发是由溶液得到晶体的方法,操作b将MgCl2溶液变成无水MgCl2,故操作b为蒸发;过滤是分离固体和液体的操作,操作a后得到固体和溶液,故操作a为过滤,在蒸发和过滤过程中都用到玻璃棒,在过滤过程中,玻璃棒的用途为引流,故填:蒸发;引流;
(3)反应①是碳酸钙高温煅烧生成氧化钙和二氧化碳,属于分解反应;反应②中,氧化钙和水生成氢氧化钙,为化合反应,氢氧化钙和氯化镁反应生成氢氧化镁和氯化钙,属于复分解反应;反应③是氢氧化镁和盐酸反应生成氯化镁和水,属于复分解反应;故上述过程中没有涉及的反应类型为置换反应;反应③的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;故填:置换反应;Mg(OH)2+2HCl=MgCl2+2H2O;
(4)该反应生产生石灰的主要原料来源于海洋中的贝壳,贝壳价格低廉,来源广,充分利用海洋化学资源、节约成本,提高经济效益,故填:充分利用海洋化学资源、节约成本,提高经济效益。

【题目】某化学兴趣小组的同学对一包久置的生石灰(化学式为CaO)干燥剂产生了好奇,于是他们对这包干燥剂的成分展开了探究。
【资 料】生石灰与水发生的反应属于放热反应
【提出问题】这包干燥剂是否变质,成分是什么?
【猜想假设】
猜想一:全部是CaO;猜想二:是CaO和Ca(OH)2的混合物;猜想三:全部是Ca(OH)2;猜想四:是Ca(OH)2和CaCO3的混合物。
【实验探究】
(1)取部分该干燥剂于试管中,加水后无放热现象,说明这包干燥剂中不含________。
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂中含有__________。
(3)为了进一步确定这包干燥剂中有无其他成分,小组同学设计了以下两种方案。
另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于2支试管中,请你参与实验并完成表中空白。
实验方案 | 方案一 | 方案二 |
实验操作 |
|
|
实验现象 | 溶液由无色变为红色,则溶液的PH______7 (填“﹤”“﹥” 或“﹦”) | 澄清溶液变浑浊 |
写出方案二发生的化学反应方程式_______________________________。
【实验结论】通过以上实验探究,得出猜想___________成立。
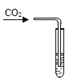
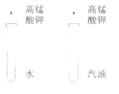
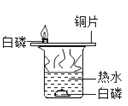
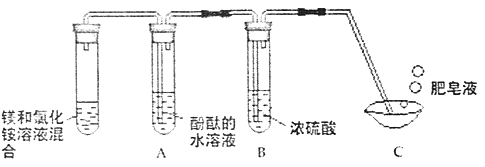
【题目】下列实验方案不能达到实验目的是( )
序号 | A | B | C | D |
目的 | 证明二氧化碳溶于水且能和水反应 | 证明碳与氧化铜能发生反应 | 探究同种溶质在不同的溶剂的溶解性 | 探究燃烧的条件是燃烧需要氧气 |
方案 |
|
|
|
|
A. AB. BC. CD. D