题目内容
【题目】某化学课堂正在进行,以下是教学片段。请你参与他们的学习并完成相关任务。
(演示实验)老师按如图所示连接好装置,加入NaHCO3粉末,点燃酒精灯,对试管预热后集中加热,烧杯中澄清石灰水变浑浊,说明生成了CO2.继续加热至无气体产生后撤出导管,熄灭酒精灯。
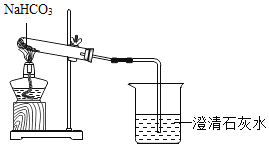
(问题提出)实验后,同学们对试管中剩余的固体粉末产生了兴趣:剩余粉末由什么物质组成?
(猜想假设)在老师的指导下,同学们对固体粉末做出了如下猜想:
猜想一:NaOH;猜想二:NaOH和Na2CO3;猜想三:Na2CO3。
(实验探究)
实验方案 | 实验操作 | 实验现象 |
方案一 | 取适量粉末溶于水后向溶液中滴入2滴酚酞溶液,摇匀 | 溶液由无色变红色 |
小明根据实验现象认为猜想一成立。小组讨论后,大家认为小明的结论不合理,理由是_____。
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案二 | 步骤一:取适量粉末溶于水后加入过量的BaCl2溶液 | _____ | 猜想一不成立 |
步骤二:取步骤一的上层清液加入MgCl2溶液2~3mL | 无明显现象 | 猜想三成立 |
(评价交流)小华认为步骤二也可以用MgSO4代替MgCl2,大家不同意他的观点,理由是_____。
(拓展延伸)(1)请你总结上述实验成果,写出碳酸氢钠受热分解的化学方程式_____。
(2)写出方案二中生成沉淀的化学方程式_____。
【答案】Na2CO3溶液呈碱性,也会使酚酞变红 有白色沉淀生成(或“变浑浊”) MgSO4与过量的BaCl2反应也会产生沉淀,影响OH-的检验 2NaHCO3![]() Na2CO3+CO2↑+H2O BaCl2+Na2CO3=BaCO3↓+2NaCl
Na2CO3+CO2↑+H2O BaCl2+Na2CO3=BaCO3↓+2NaCl
【解析】
{实验探究}方案一:可能存在的物质中,不仅氢氧化钠呈碱性,能够使无色酚酞溶液变红,碳酸钠溶液也成碱性,也能使无色酚酞溶液变红,即物质不一定是氢氧化钠,还有可能是碳酸钠,故填Na2CO3溶液呈碱性,也会使酚酞变红;
方案二:猜想一不正确,说明固体粉末中含有碳酸钠,碳酸钠与氯化钡在溶液中反应生成碳酸钡沉淀和氯化钠,观察到的现象是有白色沉淀生成,故填有白色沉淀生成。
{评价与交流}步骤一中的氯化钡是过量的,如用MgSO4代替MgCl2,硫酸镁与过量氯化钡反应生成氯化镁和硫酸钡沉淀,会误认为该白色沉淀是氢氧化镁,对检验氢氧根离子判断氢氧化钠是否存在产生干扰,故填MgSO4与过量的BaCl2反应也会产生沉淀,影响OH-的检验。
{拓展延伸}(1)碳酸氢钠在加热的条件下反应生成碳酸钠、水和二氧化碳,故反应的化学方程式写为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(2)方案二中生成沉淀的反应是氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,故反应的化学方程式写为:BaCl2+Na2CO3=BaCO3↓+2NaCl。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案