题目内容
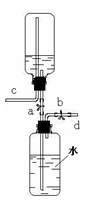
化学小组的同学用下图所示装置探究碱的性质。将适量氢氧化钠溶液放入A中,先打开止水夹Ⅰ,过一会儿,再打开止水夹Ⅱ,观察到A中溶液澄清,小试管中饱和石灰水变浑浊。
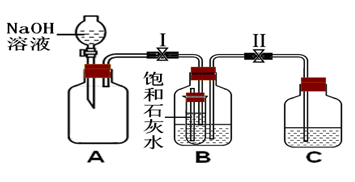
(1)若B中有气泡产生,则小试管内发生反应的化学方程式为 。C中的液体可能是 (只写一种),验证你的猜想正确的方法是 。
(2)若B中无气泡产生,则C中的液体为 。饱和石灰水变浑浊的原因是 。
(3)该实验A中发生反应的化学方程式为 。

(1)若B中有气泡产生,则小试管内发生反应的化学方程式为 。C中的液体可能是 (只写一种),验证你的猜想正确的方法是 。
(2)若B中无气泡产生,则C中的液体为 。饱和石灰水变浑浊的原因是 。
(3)该实验A中发生反应的化学方程式为 。
(1)CO2+Ca(OH)2=CaCO3↓+H2O; 酸(或碳酸盐);取少量C中的液体放入试管中,滴加紫色石蕊,紫色石蕊试液变红,证明是酸(或检验碳酸盐的方法)
(2)浓硫酸 ; 浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体。
(3)NaOH + HCl =" NaCl" + H2O
(2)浓硫酸 ; 浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体。
(3)NaOH + HCl =" NaCl" + H2O
分析:化学小组的同学用如上图所示装置探究碱的性质.将适量氢氧化钠溶液放入A中,先打开止水夹Ⅰ,过一会儿,再打开止水夹Ⅱ,观察到A中溶液澄清,小试管中饱和石灰水变浑浊.B的变浑浊有两种情况,一是生成二氧化碳,二氧化碳使之浑浊,二是溶液温度升高,所导致的.所以A中应该能够和碱反应的气体,且生成物不能和碳酸盐反应对应沉淀.
(1)若B中有气泡产生,则可书写小试管内发生反应的化学方程式.C中的液体可能是酸(只写一种),验证你的猜想正确的方法是用紫色石蕊,观察颜色变化.
(2)若B中无气泡产生,则C中的液体为浓硫酸.因为它溶于水放热,饱和石灰水变浑浊的原因是溶解度变小.
(3)因为观察到A中溶液澄清,则该实验A中发生反应的化学方程式为 氯化氢与氢氧化钠溶液反应.
解答:解:(1)若B中有气泡产生,则小试管内发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.C中的液体可能是酸(或碳酸盐);(只写一种),验证你的猜想正确的方法是取少量C中的液体放入试管中,滴加紫色石蕊,紫色石蕊试液变红,证明是酸(或检验碳酸盐的方法).
(2)若B中无气泡产生,则C中的液体为浓硫酸.饱和石灰水变浑浊的原因是浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体.
(3)A中应该能够和碱反应的气体,且生成物不能和碳酸盐反应对应沉淀.这样才能使右侧瓶内物质向左移动,也才能观察到A中溶液澄清,,所以为氯化氢气体,则该实验A中发生反应的化学方程式为:NaOH+HCl=NaCl+H2O
故答为:(1)CO2+Ca(OH)2=CaCO3↓+H2O;酸(或碳酸盐);取少量C中的液体放入试管中,滴加紫色石蕊,紫色石蕊试液变红,证明是酸(或检验碳酸盐的方法)
(2)浓硫酸;浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体.
(3)NaOH+HCl=NaCl+H2O
(1)若B中有气泡产生,则可书写小试管内发生反应的化学方程式.C中的液体可能是酸(只写一种),验证你的猜想正确的方法是用紫色石蕊,观察颜色变化.
(2)若B中无气泡产生,则C中的液体为浓硫酸.因为它溶于水放热,饱和石灰水变浑浊的原因是溶解度变小.
(3)因为观察到A中溶液澄清,则该实验A中发生反应的化学方程式为 氯化氢与氢氧化钠溶液反应.
解答:解:(1)若B中有气泡产生,则小试管内发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.C中的液体可能是酸(或碳酸盐);(只写一种),验证你的猜想正确的方法是取少量C中的液体放入试管中,滴加紫色石蕊,紫色石蕊试液变红,证明是酸(或检验碳酸盐的方法).
(2)若B中无气泡产生,则C中的液体为浓硫酸.饱和石灰水变浑浊的原因是浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体.
(3)A中应该能够和碱反应的气体,且生成物不能和碳酸盐反应对应沉淀.这样才能使右侧瓶内物质向左移动,也才能观察到A中溶液澄清,,所以为氯化氢气体,则该实验A中发生反应的化学方程式为:NaOH+HCl=NaCl+H2O
故答为:(1)CO2+Ca(OH)2=CaCO3↓+H2O;酸(或碳酸盐);取少量C中的液体放入试管中,滴加紫色石蕊,紫色石蕊试液变红,证明是酸(或检验碳酸盐的方法)
(2)浓硫酸;浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体.
(3)NaOH+HCl=NaCl+H2O

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目

 ”表示氢原子,用“
”表示氢原子,用“ ”表示氧原子,用“
”表示氧原子,用“ ”表示硫原子,上述反应过程可用下图表示:
”表示硫原子,上述反应过程可用下图表示: