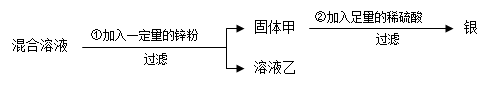
题目内容
甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验。
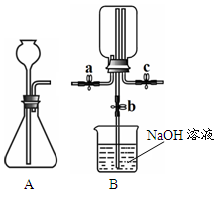
(1)甲组实验:
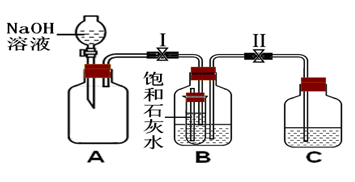
① 在A装置的锥形瓶中加入大理石,向长颈漏斗中注入稀盐酸,A中反应的化学方程式为_____。
② 连接A、B装置,打开a、c,关闭b,向B中集气瓶内充入气体,检验集气瓶中气体已收集满的方法是_____。
③ 关闭a、c,打开b,用冷毛巾捂住B中集气瓶,一段时间后,观察到B装置中的现象是_____, B中反应的化学方程式为_____。
(2)乙组实验:
【资料】氯化氢气体和氨气均极易溶于水,且两者反应生成白色固体氯化铵(NH4Cl)。
在c右端的导管口套一个气球,在A的锥形瓶中放入浓盐酸,向长颈漏斗中注入浓硫酸,有HCl气体产生,待A中的空气被排净后,连接A、B装置,打开a、c,关闭b,气球微微鼓起。产生HCl气体的原因是_____。
② 关闭a,将A中的药品替换为NaOH固体和浓氨水,待A中的空气被排净后,连接A、B装置,打开a,一段时间后关闭a,B中集气瓶内有白烟产生。冷却至室温后气球恢复原状。关闭c打开b,B中导管内的液面无任何变化。产生上述现象的原因是_____。

(1)甲组实验:
① 在A装置的锥形瓶中加入大理石,向长颈漏斗中注入稀盐酸,A中反应的化学方程式为_____。
② 连接A、B装置,打开a、c,关闭b,向B中集气瓶内充入气体,检验集气瓶中气体已收集满的方法是_____。
③ 关闭a、c,打开b,用冷毛巾捂住B中集气瓶,一段时间后,观察到B装置中的现象是_____, B中反应的化学方程式为_____。
(2)乙组实验:
【资料】氯化氢气体和氨气均极易溶于水,且两者反应生成白色固体氯化铵(NH4Cl)。
在c右端的导管口套一个气球,在A的锥形瓶中放入浓盐酸,向长颈漏斗中注入浓硫酸,有HCl气体产生,待A中的空气被排净后,连接A、B装置,打开a、c,关闭b,气球微微鼓起。产生HCl气体的原因是_____。
② 关闭a,将A中的药品替换为NaOH固体和浓氨水,待A中的空气被排净后,连接A、B装置,打开a,一段时间后关闭a,B中集气瓶内有白烟产生。冷却至室温后气球恢复原状。关闭c打开b,B中导管内的液面无任何变化。产生上述现象的原因是_____。
(1) ① CaCO3 + 2HCl = CaCl2 + H2O+ CO2↑
②将燃着的木条放在c右端的导管口处,若熄灭则气体已集满。
③烧杯中的无色液体沿导管进入到集气瓶中(或形成喷泉)
2NaOH + CO2 = Na2CO3 + H2O
(2)① 浓硫酸溶于水会放出大量热,使浓盐酸中的HCl气体溶解度减小,导致HCl
气体逸出。
② NH3和HCl恰好完全反应,集气瓶内的气压与外界大气压相等。(2分)
②将燃着的木条放在c右端的导管口处,若熄灭则气体已集满。
③烧杯中的无色液体沿导管进入到集气瓶中(或形成喷泉)
2NaOH + CO2 = Na2CO3 + H2O
(2)① 浓硫酸溶于水会放出大量热,使浓盐酸中的HCl气体溶解度减小,导致HCl
气体逸出。
② NH3和HCl恰好完全反应,集气瓶内的气压与外界大气压相等。(2分)
分析:(1)甲组实验:大理石的主要成分碳酸钙与盐酸反应时放出气体二氧化碳,二氧化碳气体密度大于空气,收集时从集气瓶底部开始慢慢充满集气瓶,当有二氧化碳从上方导管排出时,集气瓶内二氧化碳已收集满;若向集气瓶内加入少量氢氧化钠溶液,瓶内二氧化碳被吸收而使压强减小,会使氢氧化钠溶液不断进入;
(2)乙组实验:把浓硫酸加入浓盐酸中,浓硫酸遇水放出的热会加快浓盐酸的挥发,而产生大量HCl气体;HCl气体的进入使瓶内压强增大,观察到气球膨胀;当把氢氧化钠与浓氨水混合产生的氨气也通入集气瓶时,氨气与瓶内HCl气体反应形成固体氯化铵,观察到出现白烟,由于两气体的不断反应而会使瓶内气体又减少,压强渐渐接近外界大气压,观察到气球恢复原状.
解答:解:
解:(1)①大理石中的碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
②二氧化碳从a管进入,瓶内空气从位于上部的导管b排出,二氧化碳密度大于空气会从底部逐渐充满瓶子,因此,当有二氧化碳气体从b管排出时说明瓶内已收集满二氧化碳,因此可用燃烧的木条放在b导管口,木条熄灭则可证明二氧化碳已收集满;
③用冷毛巾捂住B中集气瓶,瓶内二氧化碳气体遇冷收缩引起烧杯内的氢氧化钠溶液进入集气瓶,进入瓶内的氢氧化钠溶液吸收二氧化碳而使瓶内气体减少,烧杯内氢氧化钠溶液则会更多地流入集气瓶,反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;
(2)①浓盐酸具有挥发性,当向浓盐酸中加入浓硫酸时,浓硫酸遇到溶液中的水而放出大量的热,使气体HCl的溶解度减小,加剧浓盐酸的挥发,而产生大量HCl气体;
②NaOH固体和浓氨水混合后,产生大量的氨气,氨气与集气瓶内的HCl气体发生反应生成固体氯化铵,当通入的氨气恰好与瓶内HCl气体完全反应时,瓶内压强恢复至原来的压强而与外界大气压强相等,因此气球恢复至原状,烧杯内氢氧化钠溶液不能流入集气瓶中;
故答案为:
(1)①CaCO3+2HCl=CaCl2+H2O+CO2↑;
②将燃着的木条放在c右端的导管口处,若熄灭则气体已集满;
③烧杯中的无色液体沿导管进入到集气瓶中(或形成喷泉);2NaOH+CO2=Na2CO3+H2O;
(2)①浓硫酸溶于水会放出大量热,使浓盐酸中的HCl气体溶解度减小,导致HCl气体逸出;
②NH3和HCl恰好完全反应,集气瓶内的气压与外界大气压相等.
(2)乙组实验:把浓硫酸加入浓盐酸中,浓硫酸遇水放出的热会加快浓盐酸的挥发,而产生大量HCl气体;HCl气体的进入使瓶内压强增大,观察到气球膨胀;当把氢氧化钠与浓氨水混合产生的氨气也通入集气瓶时,氨气与瓶内HCl气体反应形成固体氯化铵,观察到出现白烟,由于两气体的不断反应而会使瓶内气体又减少,压强渐渐接近外界大气压,观察到气球恢复原状.
解答:解:
解:(1)①大理石中的碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
②二氧化碳从a管进入,瓶内空气从位于上部的导管b排出,二氧化碳密度大于空气会从底部逐渐充满瓶子,因此,当有二氧化碳气体从b管排出时说明瓶内已收集满二氧化碳,因此可用燃烧的木条放在b导管口,木条熄灭则可证明二氧化碳已收集满;
③用冷毛巾捂住B中集气瓶,瓶内二氧化碳气体遇冷收缩引起烧杯内的氢氧化钠溶液进入集气瓶,进入瓶内的氢氧化钠溶液吸收二氧化碳而使瓶内气体减少,烧杯内氢氧化钠溶液则会更多地流入集气瓶,反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;
(2)①浓盐酸具有挥发性,当向浓盐酸中加入浓硫酸时,浓硫酸遇到溶液中的水而放出大量的热,使气体HCl的溶解度减小,加剧浓盐酸的挥发,而产生大量HCl气体;
②NaOH固体和浓氨水混合后,产生大量的氨气,氨气与集气瓶内的HCl气体发生反应生成固体氯化铵,当通入的氨气恰好与瓶内HCl气体完全反应时,瓶内压强恢复至原来的压强而与外界大气压强相等,因此气球恢复至原状,烧杯内氢氧化钠溶液不能流入集气瓶中;
故答案为:
(1)①CaCO3+2HCl=CaCl2+H2O+CO2↑;
②将燃着的木条放在c右端的导管口处,若熄灭则气体已集满;
③烧杯中的无色液体沿导管进入到集气瓶中(或形成喷泉);2NaOH+CO2=Na2CO3+H2O;
(2)①浓硫酸溶于水会放出大量热,使浓盐酸中的HCl气体溶解度减小,导致HCl气体逸出;
②NH3和HCl恰好完全反应,集气瓶内的气压与外界大气压相等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目