题目内容
【题目】黄铁矿(主要成分为FeS2 ,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量,进行了如下的实验探究(假设每步反应均完全),
[查阅资料]
①
②![]()
[实验探究]
I .称取1.60 g黄铁矿样品放入如图①所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
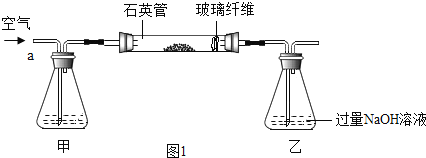
II.反应结束后,将乙瓶中的溶液进行如图②处理。

[问题讨论]
(1)I装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____。
[含量测定]
(2)II中最终得到的4.66 g固体是_____(填物质的化学式);
(3)该黄铁矿中FeS2 的质量分数_____。
[交流反思]
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会_____(填“偏大”“偏小”或“不变”);
(5) II中证明所加BaCl2溶液过量的方法是_____。
【答案】吸收空气中的二氧化碳 BaSO4 75% 偏大 取滤液少许于洁净的试管中,向其中滴加硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液过量(合理即可)
【解析】
(1)由于空气中的二氧化碳能与氢氧化钠反应影响二氧化硫的测定,所以,I装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是吸收空气中的二氧化碳。故答案为:吸收空气中的二氧化碳;
(2)乙瓶中盛放的是氢氧化钠和二氧化硫反应生成的亚硫酸钠。亚硫酸钠和氯化钡反应生成氯化钠和亚硫酸钡。由于过氧化氢具有强氧化性,能将亚硫酸钡氧化成硫酸钡,所以II中最终得到的4.66 g固体是BaSO4。故答案为:BaSO4;
(3)由于在化学变化中硫元素质量守恒,所以硫酸钡中硫元素的质量为:![]() ,则可以推测出FeS2的质量为:
,则可以推测出FeS2的质量为:![]() 。所以黄铁矿中FeS2的质量分数为:
。所以黄铁矿中FeS2的质量分数为: ![]() 。故答案为:75%;
。故答案为:75%;
(4)甲装置的作用是吸收空气中的二氧化碳。如果缺少甲装置,由于二氧化碳能与氢氧化钠反应,则导致乙中溶液的质量增重,从而导致最终测得FeS2 的质量分数将会偏大。故答案为:偏大;
(5)由于硫酸钠能与氯化钡反应生成氯化钠和硫酸钡沉淀。所以,II中证明所加BaCl2 溶液过量的方法是:取滤液少许于洁净的试管中,向其中滴加硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液过量。故答案为:取滤液少许于洁净的试管中,向其中滴加硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液过量(合理即可)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
实验编号 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 12.5 | 25.0 | 37.5 | 50.0 | 62.5 |
生成CO2的质量/g | 4.4 | 7.5 | 13.2 | 17.6 | 17.6 |
分析上述实验数据并回答:
(1)实验编号为_______的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为__________。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)________。