题目内容
【题目】化学兴趣小组为验证质量守恒定律,做镁条在空气中燃烧的实验(如图1)。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
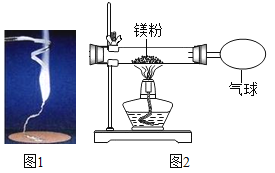
(1)镁条燃烧的化学方程式是_____;
(2)同学们通过称量发现:在石棉网上收集到的产物质量小于镁条的质量小马认为这个反应不遵循质量守恒定律。你_____(“同意”或“不同意”)他的观点。
(3)小红按如图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
将收集到的黄色固体放入试管中,加入适量的_____,在试管口放置红色石蕊试纸。 | ①_____; ②_____。 | 黄色固体是Mg3N2 |
(反思与交流)空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。
【答案】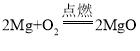 不同意 水 试管内有气泡产生,并有白色沉淀生成 红色石蕊试纸变蓝 氧气比氮气化学性质活泼
不同意 水 试管内有气泡产生,并有白色沉淀生成 红色石蕊试纸变蓝 氧气比氮气化学性质活泼
【解析】
(1)镁与氧气在点燃条件下反应生成氧化镁,所以化学方程式为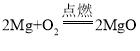 ;
;
(2)任何反应都遵循质量守恒定律,此反应中有氧气参与反应,且反应后生成的白烟扩散到空气中,没有被收集,所以造成前后质量出现误差,若在密闭装置内进行测试,则反应前后质量相等,因此不同意该同学观点;
(3) 根据题目信息,氮化镁可与水反应生成氨气,另外根据质量守恒定律可以推出另一产物为氢氧化镁,根据两种产物的特性来描述实验现象,所以将氮化镁加入试管后,加入水,氮化镁与水反应后,生成氨气会产生气泡,氢氧化镁则为白色沉淀,氨气逸出后遇到湿润的紫色石蕊试纸使其变为蓝色,所以观察到现象①试管内有气泡产生,并有白色沉淀生成;②红色石蕊试纸变蓝;
【反思与交流】生成氧化镁多于氮化镁,说明镁是先与氧气反应,后与氮气反应,因此氧气化学性质要比氮气活泼,故答案为氧气比氮气化学性质活泼。