题目内容
【题目】我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:原子利用率=![]() ×100%。在“绿色化学工艺”中,理想状态是原子利用率为100%。在用丙炔(C3H4)合成甲基丙烯酸甲酯(C5H8O2)的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
×100%。在“绿色化学工艺”中,理想状态是原子利用率为100%。在用丙炔(C3H4)合成甲基丙烯酸甲酯(C5H8O2)的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO和CH3OHB.CO2和H2OC.H2和CO2D.CH3OH和H2
【答案】A
【解析】
由题意知,绿色化学即环境友好型化学,其理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%,根据这一观点,要把一个C3H4分子变成一个C5H8O2分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中C、H、O的原子个数比为1:2:1;
A、CO和CH3OH,这两种物质如果按照分子个数比1:1组合,则很容易使C、H、O的原子个数比达到1:2:1,故正确;
B、CO2和H2O,其中两种物质里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故错误;
C、H2和CO2,其中两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故错误;
D、CH3OH和H2,其中两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故错误。
故选:A。

【题目】实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。
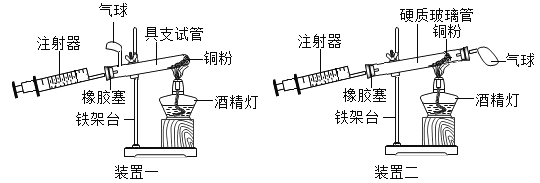
(1)在装置二中,根据下表提供的实验数据,完成下表。
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
20mL | 10 mL | 5 mL | ____ |
(2)装置一和装置二中气球的位置不同,________(填“装置一”或“装置二”)更合理,理由是________ 。
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)________;________。
(4)加热时,硬质玻璃管里发生反应的现象________,反应的文字表达式为________,该反应的基本类型是________。
【题目】矿物质水中元素及其国标含量如表所示.请回答下列问题:
矿物质水中主要成分 | |
偏硅酸 硫酸根 氯离子 | 钙 钠 钾 镁 |
(1)矿物质水中含有________种非金属元素;
(2)久置的水中会溶有一定量的氧气.请写出两个氧分子的符号:________;
(3)写出表中的一种阴离子符号:________;
(4)偏硅酸![]() 中硅元素的化合价为________价.
中硅元素的化合价为________价.