题目内容
【题目】制作糕点常用 Na2CO3或 NaHCO3 作膨松剂,我校化学兴趣小组的同学根据 Na2CO3 和 NaHCO3的性质进行了一系列探究。
(查阅资料)
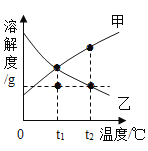
(1)溶解度比较:
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(2)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解。
(探究一)NaHCO3 和Na2CO3 溶解度差异的探究。
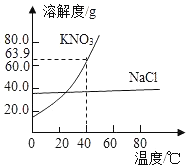
小方同学分别取 xg 两种固体粉末加入 20℃10 g 水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x 可能是_________________。
A 2 B 0.96 C 0.5 D 3
(探究二)测定某 Na2CO3和NaHCO3混合物中 NaHCO3的质量分数
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:_________________;
(2)实验中,需加热至恒重的目的是_________________。
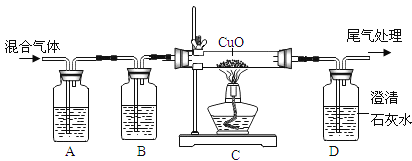
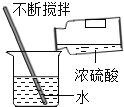
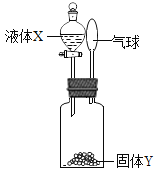
[方案二]利用下图装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量)。
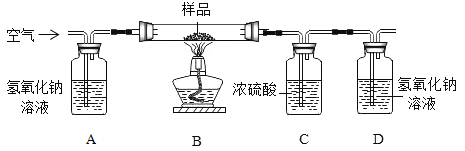
(实验步骤)
(1)检查装置的气密性; (2)称取样品 10 g,加到装置 B 中; (3)称量装置 B、C、D 的质量(含药品);(4) 连接装置; (5)加热;(6)停止加热继续通入空气;(7)再次称量装置 B、C、D 的质量(含药品)。
(数据记录)
装置B | 装置C | 装置D | |
实验前物质的质量/g | 180.0 | 200.0 | |
试验后物质的质量/g | 176.9 | 201.5 | 124.8 |
(问题回答)
①上图装置 C 的作用是_________________,装置 C 中一个明显的错误是_________________。
②实验过程中必须向装置内通入空气,装置 A 中发生的化学方程式为_________________,若没有装置 A,造成测定结果_________________ (填“偏大”“不变”或“偏小”)。
(讨论分析)
小红同学认为,表格中三组数据都可以计算该样品中 NaHCO3的质量分数,但小张认为不能用 C 装置的质量变化来计算,其理由是_________________;改进方法:_________________;小王又认为用装置 D 的质量差会偏大而影响计算,应增加一个操作:_________________,目的是_________________。
(数据处理)经过反复讨论,大家一致赞成应该利用表格中的装置 B 的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数_________________。
(拓展应用)固体Na2CO3中混有少量NaHCO3,可通过_________________方法除去。
【答案】A 2NaHCO3![]() Na2CO3+CO2↑+H2O 使碳酸氢钠完全反应 吸收碳酸氢钠分解生成的水蒸气 右侧导气管伸入过长,气体无法排出 2NaOH+CO2=Na2CO3+H2O 偏大 C装置吸收的水蒸气不仅包括碳酸氢钠分解生成的水蒸气,还包括从A进入的水蒸气 在AB之间加一个浓硫酸干燥装置 连接D装置前,缓缓鼓入空气 排净装置内的二氧化碳气体 84% 加热分解
Na2CO3+CO2↑+H2O 使碳酸氢钠完全反应 吸收碳酸氢钠分解生成的水蒸气 右侧导气管伸入过长,气体无法排出 2NaOH+CO2=Na2CO3+H2O 偏大 C装置吸收的水蒸气不仅包括碳酸氢钠分解生成的水蒸气,还包括从A进入的水蒸气 在AB之间加一个浓硫酸干燥装置 连接D装置前,缓缓鼓入空气 排净装置内的二氧化碳气体 84% 加热分解
【解析】
[探究一]
20℃碳酸钠和碳酸氢钠,溶解度分别为21.5g和9.6g10g水可溶解2.15g碳酸钠和0.96g碳酸氢钠,假如加入10g水中的碳酸钠和碳酸氢钠质量小于2.15g大于0.96g,则碳酸钠全部溶解,碳酸氢钠部分溶解,则可区分碳酸钠和碳酸氢钠,故选:A。
[探究二]
(1)坩埚中碳酸氢钠分解生成碳酸钠二氧化碳和水,化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O ,故填:2NaHCO3
Na2CO3+CO2↑+H2O ,故填:2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(2)实验中,需加热至恒重的目的是,使碳酸氢钠完全反应,故填:使碳酸氢钠完全反应。
[问题回答]
①装置 C 的作用是吸收碳酸氢钠分解生成的水蒸气,装 置 C 中一个明显的错误是右侧导气管伸入过长,气体无法排出,故填:吸收碳酸氢钠分解生成的水蒸气;右侧导气管伸入过长,气体无法排出。
②实验过程中必须向装置内通入空气,装置 A 中氢氧化钠可以吸收空气中二氧化碳,发生的化学方程式为2NaOH+CO2=Na2CO3+H2O若没有装置 A,则装置D增重偏大,认为生成的二氧化碳质量偏大,造成测定结果偏大,故填:2NaOH+CO2=Na2CO3+H2O;偏大。
[讨论分析]
小红同学认为,表格中三组数据都可以计算该样品中 NaHCO3的质量分数,但小张认为不能用 C 装置的质量变化来计算,其理由是C装置吸收的水蒸气不仅包括碳酸氢钠分解生成的水蒸气,还包括从A进入的水蒸气;改进方法:在AB之间加一个浓硫酸干燥装置,小王又认为用装置 D 的质量差会偏大而影响计算,应增加一个操作:连接D装置前,缓缓鼓入空气,目的是排净装置内的二氧化碳气体,故填:C装置吸收的水蒸气不仅包括碳酸氢钠分解生成的水蒸气,还包括从A进入的水蒸气;在AB之间加一个浓硫酸干燥装置;连接D装置前,缓缓鼓入空气;排净装置内的二氧化碳气体。
[数据处理]
利用表格中的装置 B 的质量变化进行计算 NaHCO3和 Na2CO3混合物中 NaHCO3的质量分数,设碳酸氢钠质量为x,

混合物中 NaHCO3的质量分数:![]() ,故填:84%。
,故填:84%。
[拓展应用]
固体Na2CO3中混有少量NaHCO3,可通过加热分解方法除去,故填:加热分解。