题目内容
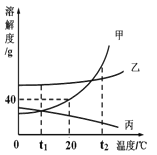
【题目】固体甲、乙(两者均不含结晶水)的溶解度曲线如图,将t2℃等质量的甲、乙饱和溶 液分别降温到t1℃。下列说法正确的是

A.甲、乙溶液仍饱和
B.溶质质量分数:甲=乙
C.溶液质量:甲<乙
D.从图中曲线可知如果乙中混有少量甲可采用冷却热饱和溶液的方法提纯乙
【答案】C
【解析】
A、因为甲的溶解度随温度的升高而增大,将t2℃甲的饱和溶液降温到t1℃,甲析出晶体,甲溶液仍饱和,而乙的溶解度随温度的升高而减小,变为不饱和溶液,故A错;
B、![]() ,由于乙的溶解度随温度的升高而减小,降温时无晶体析出,降温后溶质质量分数不变,而甲的溶解度随温度的升高而增大,从t2℃降到t1℃,甲析出晶体,溶质质量分数是t1℃时饱和溶液的溶质质量分数,甲t1℃的溶解度大于乙t2℃的溶解度,溶质质量分数甲>乙,故B错;
,由于乙的溶解度随温度的升高而减小,降温时无晶体析出,降温后溶质质量分数不变,而甲的溶解度随温度的升高而增大,从t2℃降到t1℃,甲析出晶体,溶质质量分数是t1℃时饱和溶液的溶质质量分数,甲t1℃的溶解度大于乙t2℃的溶解度,溶质质量分数甲>乙,故B错;
C、因为甲的溶解度随温度的升高而增大,将t2℃甲的饱和溶液降温到t1℃,甲析出晶体,溶液质量减小;乙的溶解度随温度的升高而减小,将t2℃乙的饱和溶液降温到t1℃时,溶解度增大,无晶体析出,变为不饱和溶液,溶液质量不变,所以甲溶液质量<乙溶液的质量,故C正确;
D、由于乙的溶解度随温度的升高而减小,所以如果乙中混有少量甲可采用升温结晶的方法提纯乙,故D错。
故选C。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】制作糕点常用 Na2CO3或 NaHCO3 作膨松剂,我校化学兴趣小组的同学根据 Na2CO3 和 NaHCO3的性质进行了一系列探究。
(查阅资料)
(1)溶解度比较:
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(2)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解。
(探究一)NaHCO3 和Na2CO3 溶解度差异的探究。
小方同学分别取 xg 两种固体粉末加入 20℃10 g 水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x 可能是_________________。
A 2 B 0.96 C 0.5 D 3
(探究二)测定某 Na2CO3和NaHCO3混合物中 NaHCO3的质量分数
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:_________________;
(2)实验中,需加热至恒重的目的是_________________。
[方案二]利用下图装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量)。

(实验步骤)
(1)检查装置的气密性; (2)称取样品 10 g,加到装置 B 中; (3)称量装置 B、C、D 的质量(含药品);(4) 连接装置; (5)加热;(6)停止加热继续通入空气;(7)再次称量装置 B、C、D 的质量(含药品)。
(数据记录)
装置B | 装置C | 装置D | |
实验前物质的质量/g | 180.0 | 200.0 | |
试验后物质的质量/g | 176.9 | 201.5 | 124.8 |
(问题回答)
①上图装置 C 的作用是_________________,装置 C 中一个明显的错误是_________________。
②实验过程中必须向装置内通入空气,装置 A 中发生的化学方程式为_________________,若没有装置 A,造成测定结果_________________ (填“偏大”“不变”或“偏小”)。
(讨论分析)
小红同学认为,表格中三组数据都可以计算该样品中 NaHCO3的质量分数,但小张认为不能用 C 装置的质量变化来计算,其理由是_________________;改进方法:_________________;小王又认为用装置 D 的质量差会偏大而影响计算,应增加一个操作:_________________,目的是_________________。
(数据处理)经过反复讨论,大家一致赞成应该利用表格中的装置 B 的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数_________________。
(拓展应用)固体Na2CO3中混有少量NaHCO3,可通过_________________方法除去。
【题目】搞好环境卫生和个人卫生有益健康。下表是生活中常见的清洁用品。
产品 | 免洗洗手液 | 彩漂剂 | 84 消毒液 | 洁厕灵 |
有效成分 | 75%酒精 | 过氧化氢 | 次氯酸钠 | 氯化氢 |
(1)下列关于酒精的使用说法错误的是____。
A 贴好标签,密封放置
B 失火时可用湿抹布盖灭
C 远离火源,远离儿童
D 为使消毒效果更好,应在家中大量喷洒
(2)“彩漂剂”长期存放会失效,用化学方程式解释失效的原因______ 。
(3)配制和使用高浓度消毒剂为教室消毒时,应注意的事项是______ (填序号)。
A  佩戴防护眼镜 B
佩戴防护眼镜 B  佩戴安全帽
佩戴安全帽
C  注意通风 D
注意通风 D  佩戴防护手套
佩戴防护手套
(4)如图为某“84 消毒液”瓶体上的部分标签。

①NaClO 中氯元素的化合价为____,“84 消毒液” 与“洁厕灵”混用会生成黄绿色的有毒气体——氯气, 氯气的化学式为___ 。
②该消毒液每瓶至少含氯元素_____g。