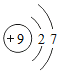题目内容
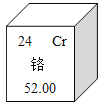
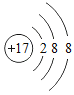
【题目】2019年被联合国大会确定为“国际化学元素周期表年”。如图是元素周期表中的一格,其中20.18表示氖的____________,该元素在元素周期表中位于第__________周期。地壳中含量最多的金属元素和地壳中含量最多的非金属元素组成的化合物的化学式为____________。

【答案】相对原子质量 二 Al2O3
【解析】
元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量。
由元素周期表中的一格可知,其中20.18表示氖的相对原子质量;
该元素的原子含有两个电子层,故在元素周期表中位于第二周期;
地壳中含量最多的金属元素是铝元素,地壳中含量最多的非金属元素是氧元素,故地壳中含量最多的金属元素和地壳中含量最多的非金属元素组成的化合物是氧化铝,氧元素的化合价为-2价,铝元素的化合价为+3价,故化学式为Al2O3。

 名校课堂系列答案
名校课堂系列答案【题目】制作糕点常用 Na2CO3或 NaHCO3 作膨松剂,我校化学兴趣小组的同学根据 Na2CO3 和 NaHCO3的性质进行了一系列探究。
(查阅资料)
(1)溶解度比较:
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(2)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解。
(探究一)NaHCO3 和Na2CO3 溶解度差异的探究。
小方同学分别取 xg 两种固体粉末加入 20℃10 g 水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x 可能是_________________。
A 2 B 0.96 C 0.5 D 3
(探究二)测定某 Na2CO3和NaHCO3混合物中 NaHCO3的质量分数
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:_________________;
(2)实验中,需加热至恒重的目的是_________________。
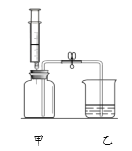
[方案二]利用下图装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量)。
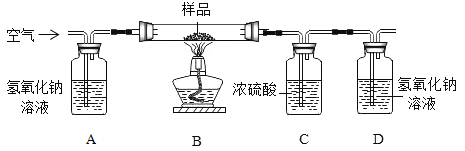
(实验步骤)
(1)检查装置的气密性; (2)称取样品 10 g,加到装置 B 中; (3)称量装置 B、C、D 的质量(含药品);(4) 连接装置; (5)加热;(6)停止加热继续通入空气;(7)再次称量装置 B、C、D 的质量(含药品)。
(数据记录)
装置B | 装置C | 装置D | |
实验前物质的质量/g | 180.0 | 200.0 | |
试验后物质的质量/g | 176.9 | 201.5 | 124.8 |
(问题回答)
①上图装置 C 的作用是_________________,装置 C 中一个明显的错误是_________________。
②实验过程中必须向装置内通入空气,装置 A 中发生的化学方程式为_________________,若没有装置 A,造成测定结果_________________ (填“偏大”“不变”或“偏小”)。
(讨论分析)
小红同学认为,表格中三组数据都可以计算该样品中 NaHCO3的质量分数,但小张认为不能用 C 装置的质量变化来计算,其理由是_________________;改进方法:_________________;小王又认为用装置 D 的质量差会偏大而影响计算,应增加一个操作:_________________,目的是_________________。
(数据处理)经过反复讨论,大家一致赞成应该利用表格中的装置 B 的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数_________________。
(拓展应用)固体Na2CO3中混有少量NaHCO3,可通过_________________方法除去。