题目内容
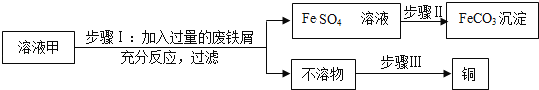
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A.一定不存在Ba2+,NH4+可能存在B.CO32-一定存在
C.Na+一定不存在D.一定不存在Cl-
【答案】B
【解析】
根据①可知生成的气体为氨气,其质量为0.68g,可求出溶液中铵根离子的质量为:![]() ;根据②可知2.33g沉淀为硫酸钡,6.27g沉淀为硫酸钡和碳酸钡的混合物,碳酸钡的质量为:6.27g-2.33g=3.94g;则原溶液中一定存在CO32-、SO42-;根据离子共存,溶液中一定不存在Ba2+;同时可以求出溶液中硫酸根的质量为:
;根据②可知2.33g沉淀为硫酸钡,6.27g沉淀为硫酸钡和碳酸钡的混合物,碳酸钡的质量为:6.27g-2.33g=3.94g;则原溶液中一定存在CO32-、SO42-;根据离子共存,溶液中一定不存在Ba2+;同时可以求出溶液中硫酸根的质量为:![]() ;溶液中碳酸根的质量为:
;溶液中碳酸根的质量为:![]() ;由于个数比等于质量除以相对分子质量之比,溶液中铵根:硫酸根:碳酸根的个数比=
;由于个数比等于质量除以相对分子质量之比,溶液中铵根:硫酸根:碳酸根的个数比=![]() ;根据化学式可知,一个碳酸根与两个铵根结合成碳酸铵,一个硫酸根与两个铵根结合成硫酸铵;若无其他离子,溶液中的阳离子与阴离子电荷数之比为:
;根据化学式可知,一个碳酸根与两个铵根结合成碳酸铵,一个硫酸根与两个铵根结合成硫酸铵;若无其他离子,溶液中的阳离子与阴离子电荷数之比为:![]() ; 根据溶液中阴阳离子的电荷数守恒得,可得阳离子数目不够,需要另外的阳离子,因此溶液中还肯定有Na+;由于没有对氯离子的存在进行检验,因此不能确定溶液中是否含有氯离子,根据分析可知,原溶液中一定存在Na+、NH4+、CO32-、SO42-;一定不存在Ba2+,可能含有Cl-。
; 根据溶液中阴阳离子的电荷数守恒得,可得阳离子数目不够,需要另外的阳离子,因此溶液中还肯定有Na+;由于没有对氯离子的存在进行检验,因此不能确定溶液中是否含有氯离子,根据分析可知,原溶液中一定存在Na+、NH4+、CO32-、SO42-;一定不存在Ba2+,可能含有Cl-。
故选B

【题目】稀盐酸与氢氧化钠溶液混合后,发现溶液仍为无色。为了证明她们确实发生了化学反应,某学习小组进行如下实验:
|
|
图1 | 图2 |
| |
图3 | |
① 图1中从a→b整个实验过程中观察到的现象是_________________,由此证明上述实验过程确实发生了化学反应。
② 图2表示反应过程中溶液的PH变化情况,c点表示的意义是________________;当溶液的pH=2时,此溶液的溶质有_______________。
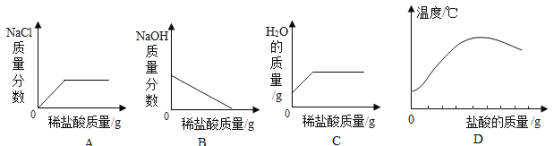
③ 图3表示向一定量的氢氧化钠溶液中逐滴加入稀盐酸至过量,图像中能正确反应对应变化关系的是________________。
④ 为测定氢氧化钠溶液的质量分数,取氢氧化钠溶液50g,用10%的稀盐酸进行测定,当加入稀盐酸为36.5g时恰好完全反应。
I. 稀盐酸中含HCl的物质的量是_____mol;
II. 氢氧化钠溶液的质量分数是___________。(根据化学方程式列式计算)
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。