题目内容
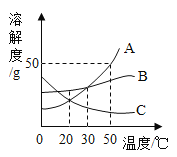
【题目】70 ℃时,将100 g溶质的质量分数为20%的R溶液不断降温,析出固体R的质量与温度的变化关系如下图所示。根据图像回答下列问题:
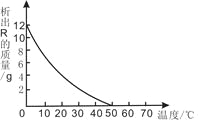
(1) R的溶解度随温度的升高而______________(填“增大”、“不变”或“减小”);
(2)从70 ℃降到50 ℃的过程中,该溶液中溶质的质量分数_________(填“变大”、“变小”或“不变”);
(3)要配制50℃时50 g R的饱和溶液,需要R的质量是 ________ g , 需要的玻璃仪器有_________ 。
【答案】增大 不变 10 g 烧杯、玻璃棒、量筒(50mL)、胶头滴管
【解析】
(1)由图可知R随温度的升高析出固体R的质量减小,固体R溶解到溶液中,所以R的溶解度随温度的升高而增大
(2)从70 ℃降到50 ℃的过程中,没有固体析出,溶质不变,该溶液中溶质的质量分数也不会变
(3)50℃时溶液刚好饱和,R的饱和溶液的溶质的质量分数为20%,50 g R的饱和溶液的溶质=50 g![]() 20%=10g,需要用到的仪器有托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙等,玻璃仪器有烧杯、玻璃棒、量筒(50mL)、胶头滴管
20%=10g,需要用到的仪器有托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙等,玻璃仪器有烧杯、玻璃棒、量筒(50mL)、胶头滴管

【题目】甲、乙同学利用如下装置验证氢氧化钠能与二氧化碳反应.(装置气密性良好)
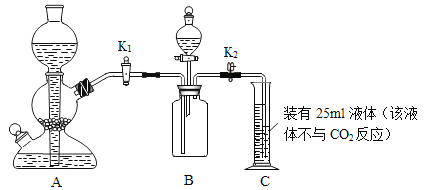
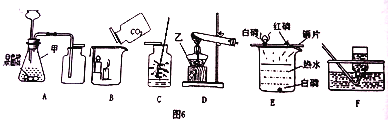
①装置A用于制取二氧化碳,写出装置A中制取二氧化碳的化学反应方程式____.
②使A中反应暂停的操作是____.
③甲同学打开装置B中分液漏斗活塞,将8mL室温时氢氧化钠饱和溶液滴入B中,然后关闭漏斗活塞,打开____(填K1或K2),观察到C中液体倒流至B中.甲同学得出结论,氢氧化钠能与二氧化碳反应.
乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验.请完成以下表格:(步骤同上,略)
分液漏斗内液体 | 现象 | 结论 |
甲同学:室温时8mL氢氧化钠饱和溶液. | 量筒中液体倒流入B中,且量筒内液面下降至10ml刻度处. | 二氧化碳与氢氧化钠发生反应. |
乙同学:____. | 量筒中液体倒流入B中,且量筒内液面下降至___10ml刻度处.(填“>”、“<”或“=”) |