题目内容
【题目】黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,利用以下实验可制取补血剂原料碳酸亚铁并回收铜。
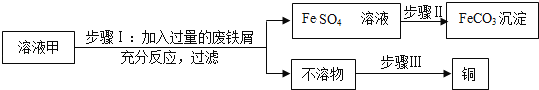
步骤I中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe→3FeSO4,
②_____,
③_____。
步骤II中加入一种试剂(Na2CO3)可实现其转化,将试剂(Na2CO3)进行焰色反应,观察得到的火焰颜色是__________色。
步骤III回收铜的主要实验操作包括:①过滤,②加足量稀硫酸,③洗涤、干燥,正确的操作顺序是_____(填序号)。
若废铁屑含有少量铁锈,对回收铜_____(填“有”或“无”)影响。
【答案】![]()
![]() 黄 ②①③ 无
黄 ②①③ 无
【解析】
铁能与硫酸反应生成硫酸亚铁溶液和氢气,铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜。
步骤I中,铁能与硫酸反应生成硫酸亚铁溶液和氢气,铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式分别是Fe+H2SO4═FeSO4+H2↑、Fe+CuSO4═FeSO4+Cu。
Na2CO3中含有钠元素,灼烧时火焰的颜色呈黄色。
步骤III中,不溶物是铁和铜的混合物,应先加足量稀硫酸,铁能与稀硫酸反应,铜不能,再过滤、洗涤、干燥,正确的操作顺序是②①③。
步骤I中加入过量废铁屑,可以将溶液中的硫酸铁、硫酸铜以及硫酸转化为硫酸亚铁,废铁屑含有少量铁锈,则若废铁屑含有少量铁锈,氧化铁与硫酸反应生成的硫酸铁能与铁继续反应生成硫酸亚铁,故对回收铜没有影响

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】实验与探究是化学学习的重要方法。
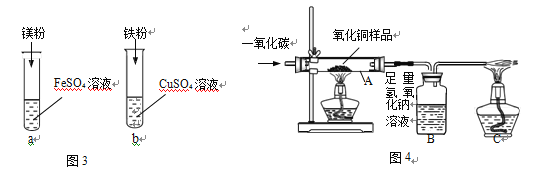
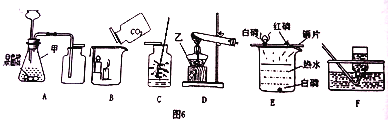
①甲同学探究镁、铁、铜三种金属的活动性顺序,设计了上图 3 所示实验方案。
(I)根据实验 a、b 观察到的现象,得出金属活动性顺序是__________。
(II)将 a、b 试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加 入稀硫酸,有气泡产生,则滤渣的成分可能是__________。
②现有含杂质的氧化铜样品(杂质不参加反应),为测定该样品中氧化铜的质量分数,乙同 学取样品 Wg,并用上图 4 装置进行实验。
(I)装置 A 中反应的化学方程式为__________。
(II)为达到实验目的,还需要测量的数据是__________。
③丙同学用三支试管分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液进行实验探究。
(I)步骤 1:向三支试管分别滴加无色酚酞试液后,Na2CO3溶液中显红色,说明 Na2CO3溶液显_________性。
(II)步骤 2:丙同学把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最 终有白色沉淀生成且溶液显红色;过滤,得到滤液,滤液中一定不含有__________(填编号)。
A稀盐酸 B澄清石灰水 C碳酸钠溶液 D氯化钾
(III)(实验猜想) 步骤 2 所得滤液中溶质可能为:
猜想一:NaCl、Na2CO3; 猜想二:NaCl、CaCl2和NaOH;
猜想三:NaCl、Na2CO3和NaOH; 猜想 …………
(实验设计)
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中, 加入过量 CaCl2溶液 | __________________ | 猜想三成立 |
(实验分析)上述实验操作结束后,试管中溶质的成分为__________。
【题目】甲、乙同学利用如下装置验证氢氧化钠能与二氧化碳反应.(装置气密性良好)
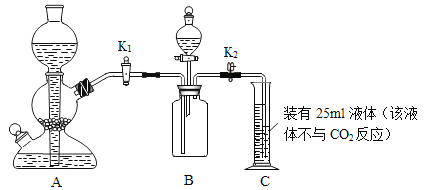
①装置A用于制取二氧化碳,写出装置A中制取二氧化碳的化学反应方程式____.
②使A中反应暂停的操作是____.
③甲同学打开装置B中分液漏斗活塞,将8mL室温时氢氧化钠饱和溶液滴入B中,然后关闭漏斗活塞,打开____(填K1或K2),观察到C中液体倒流至B中.甲同学得出结论,氢氧化钠能与二氧化碳反应.
乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验.请完成以下表格:(步骤同上,略)
分液漏斗内液体 | 现象 | 结论 |
甲同学:室温时8mL氢氧化钠饱和溶液. | 量筒中液体倒流入B中,且量筒内液面下降至10ml刻度处. | 二氧化碳与氢氧化钠发生反应. |
乙同学:____. | 量筒中液体倒流入B中,且量筒内液面下降至___10ml刻度处.(填“>”、“<”或“=”) |