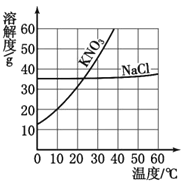
题目内容
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。
【答案】 10: 10.5%。
【解析】
根据加入相同质量、相同质量分数的稀盐酸后,前两次都是固体减少4g,而第三次只减少2g,说明此时已经完全无反应,说明剩余的固体为杂质,碳酸钙的质量为12g﹣2g=10g。
设生成的氯化钙的质量为x,生成的二氧化碳的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
10g x y
![]() =
=![]() =
=![]()
x=11.1g
y=4.4g
第4次加入稀盐酸后所得溶液中CaCl2的质量分数为![]() ×100%≈10.5%
×100%≈10.5%
答:(1)样品中碳酸钙的质量为 10g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数10.5%。

【题目】在宏观、微观和符号之间建立联系是化学学科特点.
(1)在水、铜、氯化钠3种物质中,由原子构成的是_______.
(2)A、B、C、D表示4种物质,部分物质的微观示意图见表.A和B在不同条件下反应生成C或D.
物质 | B | C | D |
|
微观示意图 |
|
|
|
请回答以下问题:
①B、C、D三种物质都是由(填“分子”、“原子”或“离子”)_______构成的.
②B、C、D中属于化合物的是(填序号)_______.
③一个D分子由_____个原子构成.
④C、D都由碳、氧元素组成,但它们每个分子的构成________(填“相同”或“不同”),其性质有很大的差异。