题目内容
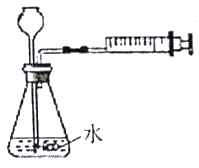
【题目】兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了如下探究实验。请你与他们一起完成以下探究活动:
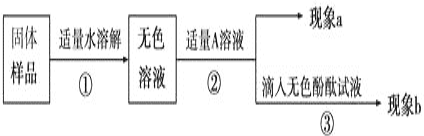
【对固体猜想】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:_____________。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是_____________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式___________________________________。
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为___________(填化学式),该实验________(填“能”或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为____________________,现象b为______________,则猜想Ⅱ成立。
(4)若用PH试纸测定操作①所得无色溶液的PH,操作方法为____________________________。
【答案】 NaOH和Na2CO3 稀盐酸, Na2CO3 + 2HCl= 2NaCl + H2O + CO2↑ CaCO3, 不能 。 有白色沉淀生成(变浑浊), 不变红, 将一小片PH试纸放在玻璃片(白瓷板)上,用玻璃棒沾取待测液滴到PH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的PH。
【解析】氢氧化钠长期放置时易与空气中的二氧化碳反应生成碳酸钠而变质。完全变质时,剩余物只有碳酸钠,部分变质时,剩余物是氢氧化钠和碳酸钠。(1)碳酸钠和酸反应生成二氧化碳,产生气泡,若现象a为有气泡产生,则加入的A溶液是稀盐酸,说明氢氧化钠已经变质,碳酸钠和盐酸反应生成二氧化碳,产生气泡,反应的化学方程式:Na2CO3 + 2HCl= 2NaCl + H2O + CO2↑;(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为碳酸钠和氢氧化钙反应生成的碳酸钙沉淀,化学式为CaCO3,该实验因生成氢氧化钠,不能说明样品中有NaOH;(3)若A是CaCl2溶液,当实验现象a为生成白色沉淀,现象b为酚酞试液变红,则猜想Ⅱ成立,因碳酸钠和氯化钙反应生成碳酸钙和氯化钠,通过此反应除掉呈碱性的碳酸钠,酚酞试液变红说明有氢氧化钠;(4)若用pH试纸测定操作①所得无色溶液的pH,操作方法为:将一小片pH试纸放在玻璃片(白瓷板)上,用玻璃棒沾取待测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的PH。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案