题目内容
【题目】我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
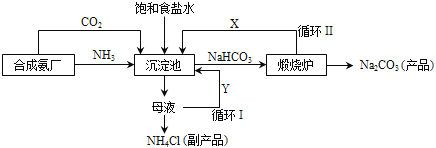

(1)上述生产纯碱的方法称____________________,副产品的一种用途为_________________。
(2)向沉淀池中通入两种气体,先通入的是________________(填“NH3”或“CO2”),沉淀池发生的化学反应方程式是_______________________________。
(3)写出上述流程中X物质的化学式_____________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____________(填“循环I”或“循环II”)。从沉淀池中取出NaHCO3沉淀的操作是__________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的_______,排除Na2CO3的干扰,再滴加___________。
【答案】 联合制碱法或侯氏制碱法 化肥(其他合理答案均给分) NH3 NH3+CO2+H2O+NaCl==NH4Cl+NaHCO3↓
(或 NH3+CO2+H2O==NH4HCO3 NH4HCO3+NaCl==NaHCO3↓+NH4Cl,写对一个得1分) CO2 循环I 过滤 稀硝酸 硝酸银溶液
【解析】根据所学知识和题中信息知,(1)上述生产纯碱的方法称联合制碱法或侯氏制碱法,这是候德邦教授发明的制碱法,副产品有氯化铵,其一种用途为化肥。(2)向沉淀池中通入两种气体,先通入的是NH3,沉淀池发生的化学反应方程式是NH3+CO2+H2O+NaCl==NH4Cl+NaHCO3↓,碳酸氢钠易溶于水,但不溶于氯化铵溶液。(3)流程中X物质的化学式是CO2。(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环I,氯化钠溶液反复充分利用。从沉淀池中取出NaHCO3沉淀的操作是过滤,碳酸氢钠易溶于水,但不溶于氯化铵溶液。﹙5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的稀硝酸,排除Na2CO3的干扰,再滴加硝酸银溶液,硝酸银溶液与氯化钠溶液反应生成氯化银白色沉淀,该沉淀不溶于硝酸。
点睛∶碳酸氢钠易溶于水,但不溶于氯化铵溶液。硝酸银溶液与氯化钠溶液反应生成氯化银白色沉淀,该沉淀不溶于硝酸。

【题目】为鉴别NaCl溶液和Na2CO3溶液,甲、乙、丙三位同学设计方案如下:
甲 | 乙 | 丙 | |
实验操作 | 分别滴加酚酞试液
| 分别滴加______溶液
| 分别滴加BaCl2溶液
|
现象与结论 | 呈____色的是Na2CO3溶液,无色的是NaCl溶液 | 冒气泡的是Na2CO3溶液,无明显现象的是NaCl溶液 | 有____的Na2CO3溶液,无明显现象的是NaCl溶液 |
丙同学实验后将两只试管中的物质倒入洁净烧杯,静置后取上层清液,滴加稀硫酸观察到 ______,可知上层清液中含有BaCl2,为避免可溶性钡盐引起水体重金属污染,可向废液中加适量_______再排放。
A.碳酸钠溶液 B.硫酸钠溶液 C.硝酸银溶液 D.水