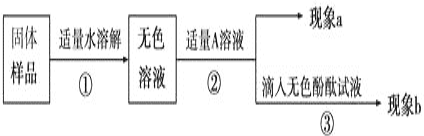
题目内容
【题目】将22.2gCu2(OH)2CO3放在密闭容器内高温加热一段时间后,冷却,测得剩余固体的质量为15.2g。在剩余固体里加入100.0g稀硫酸恰好完全反应,过滤得红色金属。已知:Cu2O+H2SO4 =Cu+CuSO4+H2O,下列说法正确的是
A. 15.2g剩余固体是纯净物 B. 过程中生成CO2和H2O的质量和为7.0g
C. 残留红色金属质量为12.8g D. 稀硫酸的溶质质量分数为14.7%
【答案】D
【解析】分析:根据题中信息可知,碱式碳酸铜分解时,部分生成了氧化铜,部分生成氧化亚铜,设分解生成氧化铜的碱式碳酸铜的质量为m,生成氧化铜的质量为x,则
Cu2(OH)2CO3![]() CuO + H2O + CO2↑
CuO + H2O + CO2↑
222 80
m x 得① 222/m=80/x
2Cu2(OH)2CO3![]() 2 Cu2O + 2H2O + 2CO2↑+ O2↑
2 Cu2O + 2H2O + 2CO2↑+ O2↑
2×222 2×144
22.2g-m 15.2g-x 得② 2×222/ 2×144=(22.2g-m)/( 15.2g-x)
由①②计算可得m=11.1g x=8g
因此生成氧化铜、氧化亚铜的碱式碳酸铜的质量均为11.1g,生成氧化亚铜的质量为15.2g -8g=7.2g;设生成铜的质量为y,与氧化亚铜反应的硫酸的质量为n1,与氧化铜反应的硫酸的质量为n2,则:
Cu2O + H2SO4 = Cu+CuSO4+H2O
144 98 64
7.2g n1 y
![]() n1=4.9g y=3.2g
n1=4.9g y=3.2g
CuO + H2SO4 = CuSO4+H2O
80 98
8g n2
![]() n2=9.8g
n2=9.8g
所以:A. 剩余固体加硫酸后生成铜,说明15.2g剩余固体是氧化铜和氧化亚铜,是混合物,错误; B. 过程中生成CO2和H2O、氧气的质量和为7.0g,错误;C. 残留红色金属为铜,质量是3.2g,错误;D. 稀硫酸的溶质质量分数为(9.8g+4.9g)÷100g×100%=14.7%,正确。故选D。

【题目】为鉴别NaCl溶液和Na2CO3溶液,甲、乙、丙三位同学设计方案如下:
甲 | 乙 | 丙 | |
实验操作 | 分别滴加酚酞试液
| 分别滴加______溶液
| 分别滴加BaCl2溶液
|
现象与结论 | 呈____色的是Na2CO3溶液,无色的是NaCl溶液 | 冒气泡的是Na2CO3溶液,无明显现象的是NaCl溶液 | 有____的Na2CO3溶液,无明显现象的是NaCl溶液 |
丙同学实验后将两只试管中的物质倒入洁净烧杯,静置后取上层清液,滴加稀硫酸观察到 ______,可知上层清液中含有BaCl2,为避免可溶性钡盐引起水体重金属污染,可向废液中加适量_______再排放。
A.碳酸钠溶液 B.硫酸钠溶液 C.硝酸银溶液 D.水