题目内容
【题目】发酵粉的主要成分中含有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行如下探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
(1)用pH试纸测得碳酸氢钠溶液的pH约为9,可知碳酸氢钠溶液________性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料] 碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
[实验1] 如图所示,取一定量的碳酸氢钠放到铜片上加热。

(2)加热一段时间后,观察到烧杯内壁产生___________(填现象)。
(3)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是______________。
(4)欲通过实验探究进一步确定充分加热后的固体产物的成分。
猜想1:可能是NaOH;猜想2:可能是Na2CO3;猜想3:可能是NaOH和Na2CO3。
实验2:
实验操作(步骤) | 实验现象 | 实验结论 |
①将该固体溶于水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸 | 有气体产生 | 猜想_______不成立 |
②另取少量溶液于试管中,滴加_____ | _____ | 固体产物中含Na2CO3 |
③取步骤②所得上层清液,滴加_____ | 无明显现象 | 猜想2成立 |
[实验结论]
(5)NaHCO3受热易分解,反应化学方程式为_________________________________________。
Ⅱ.定量探究
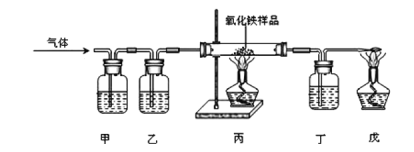
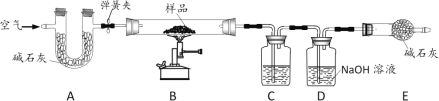
为测定某发酵粉中碳酸氢钠的质量分数(发酵粉中其他组分不参与反应),设计了如下实验。
[查阅资料] 碱石灰是氧化钙和氢氧化钠固体的混合物。
[实验步骤]
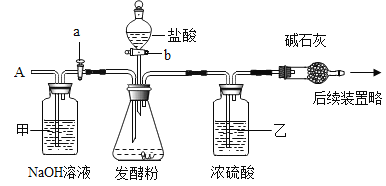
①取50g样品于锥形瓶中,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气;
②关闭活塞a,打开活塞b,加入足量的稀盐酸,直至锥形瓶内不再产生气泡;
③关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气,直至干燥管内物质质量不再增加;
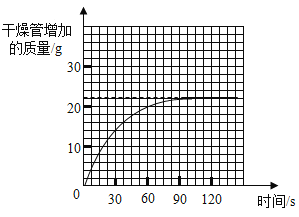
④测量干燥管增加的质量与时间关系(见曲线图)。
(1)步骤①加入样品前还应___________________。
(2)装置乙的作用是_________________________。
(3)步骤③鼓入一定量空气的目的是_________________________________。
(4)若缺少装置甲,将导致结果_________(选填“偏大”、“偏小”或“不变”)。
(5)实验测得干燥管增加的质量与时间关系(见曲线图),涉及反应的方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。请回答:
①生成二氧化碳的质量为_______g。
②该样品中碳酸氢钠的质量分数。(写出计算过程)______。
(6)[拓展应用]
①碳酸氢钠、氢氧化镁、氢氧化铝等常用于制作抗酸药,用来治疗胃酸过多。但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠,其原因是____________________。
②实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,你能否设计一个实验进行鉴别,请简述你的实验方案、现象和结论______________________________________________。
【答案】碱 水珠 二氧化碳 1 足量的氯化钡溶液 有白色沉淀生成 酚酞试液 2NaHCO3![]() Na2CO3+CO2↑+H2O 检查装置的气密性 吸收气体中的水,避免水对测定结果的影响 将二氧化碳全部赶入碱石灰中,与之充分反应 偏大 22g 84% 碳酸氢钠能和胃酸反应生成二氧化碳气体,可能引起胃穿孔,加重病情 取样,分别放入试管中加热,无明显变化的是碳酸钠,试管壁有水珠且产生的气体能使澄清石灰水变浑浊的是碳酸氢钠
Na2CO3+CO2↑+H2O 检查装置的气密性 吸收气体中的水,避免水对测定结果的影响 将二氧化碳全部赶入碱石灰中,与之充分反应 偏大 22g 84% 碳酸氢钠能和胃酸反应生成二氧化碳气体,可能引起胃穿孔,加重病情 取样,分别放入试管中加热,无明显变化的是碳酸钠,试管壁有水珠且产生的气体能使澄清石灰水变浑浊的是碳酸氢钠
【解析】
当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;根据碳酸氢钠的化学性质分析;检验生成物是NaOH还是Na2CO3,加入氯化钡溶液可以与碳酸钠反应产生沉淀的物质,据此进行分析解答.碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,写出反应的化学方程式即可;根据反应的化学方程式结合题干提供的数据进行分析解答即可。
Ⅰ.定性探究:
(1)用pH试纸测得碳酸氢钠溶液的pH为9,大于7,显碱性;
(2)碳酸氢钠受热容易分解,生成水,所以:加热一段时间后,观察到烧杯内壁有水珠;
(3)二氧化碳能使澄清的石灰水变浑浊,说明碳酸氢钠受热能分解生成二氧化碳气体;
(4)实验2:加入盐酸有气泡产生,说明一定生成了碳酸钠,故猜想1不合理;检验生成物是NaOH还是Na2CO3,加入足量的氯化钡(或氯化钙)溶液可以与碳酸钠溶液反应产生白色沉淀,若有白色沉淀生成,说明固体产物是Na2CO3,取反应后的上层清液,向其中滴加酚酞试液,酚酞试液不变红,说明溶液中不含氢氧根,说明固体产物中不含氢氧化钠,即猜想2成立;
(5)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,反应的化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
Ⅱ.定量探究:
(1)步骤①加入样品前还应检查装置的气密性;
(2)装置乙:浓硫酸具有吸水性,混合气体通过浓硫酸时,硫酸吸收气体中的水,避免水对测定结果的影响;
(3)步骤③鼓入一定量空气后,可以将发酵粉和盐酸反应生成的二氧化碳全部赶入碱石灰中,与之充分反应;
(4)装置甲:空气中的二氧化碳能被NaOH溶液吸收,通过NaOH溶液后的空气中不再含有二氧化碳,避免了空气中二氧化碳对测定结果的影响,防止测定的数据偏大;
(5)分析坐标图可知:干燥管中增加的质量为22g,则生成的二氧化碳的质量为22g;设样品中碳酸氢钠的质量为x,

![]()
x=42g,
该样品中碳酸氢钠的质量分数=![]() ×100%=84%;
×100%=84%;
(6)[拓展应用]
①碳酸氢钠与酸反应能生成二氧化碳气体,生成的二氧化碳使胃中气压增大,可能引起胃穿孔,加重病情;
②碳酸钠受热不分解,碳酸氢钠受热易分解,故可以取样加热,观察现象,方案为:取样,分别放入试管中加热,无明显变化的是碳酸钠,试管壁有水珠且产生的气体能使澄清石灰水变浑浊的是碳酸氢钠。