题目内容
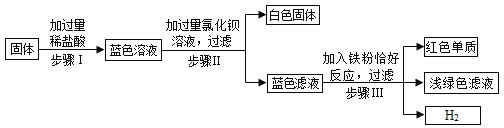
【题目】金属及金属材料在生产、生活中应用广泛。

(1)生活中使用的铜火锅是利用铜的______性。
(2)铁制品锈蚀主要是铁与______作用的结果,在空气中易生锈,生活中防盗门的防锈常采用的方法是______。
(3)为验证铁和铜的金属活动性顺序,小明设计了如图所示的实验。能说明铁比铜金属活动性强的实验现象是______;小亮选择了铁片和______(填一种试剂)也得出同样的结论。
【答案】导热 水和氧气 涂漆 铜片表面无明显现象,铁片表面产生气泡 硫酸铜溶液
【解析】
(1)生活中使用的铜火锅是利用铜的导热性;
(2)铁制品锈蚀主要是铁与水和氧气作用的结果,在空气中易生锈,生活中防盗门的防锈常采用的方法是涂漆,以隔绝水和氧气;
(3)能说明铁比铜金属活动性强的实验现象是铜片表面无明显现象,铁片表面产生气泡,即铜不能和稀盐酸反应,铁能和稀盐酸反应,说明铁比铜活泼;小亮选择了铁片和硫酸铜溶液也得出同样的结论,例如把铁丝伸入硫酸铜溶液中,铁丝表面析出红色固体,是因为铁和硫酸铜反应生成硫酸亚铁和铜,即铁比铜活泼。

 字词句段篇系列答案
字词句段篇系列答案【题目】发酵粉的主要成分中含有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行如下探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
(1)用pH试纸测得碳酸氢钠溶液的pH约为9,可知碳酸氢钠溶液________性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料] 碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
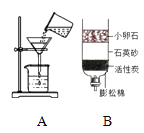
[实验1] 如图所示,取一定量的碳酸氢钠放到铜片上加热。

(2)加热一段时间后,观察到烧杯内壁产生___________(填现象)。
(3)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是______________。
(4)欲通过实验探究进一步确定充分加热后的固体产物的成分。
猜想1:可能是NaOH;猜想2:可能是Na2CO3;猜想3:可能是NaOH和Na2CO3。
实验2:
实验操作(步骤) | 实验现象 | 实验结论 |
①将该固体溶于水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸 | 有气体产生 | 猜想_______不成立 |
②另取少量溶液于试管中,滴加_____ | _____ | 固体产物中含Na2CO3 |
③取步骤②所得上层清液,滴加_____ | 无明显现象 | 猜想2成立 |
[实验结论]
(5)NaHCO3受热易分解,反应化学方程式为_________________________________________。
Ⅱ.定量探究
为测定某发酵粉中碳酸氢钠的质量分数(发酵粉中其他组分不参与反应),设计了如下实验。
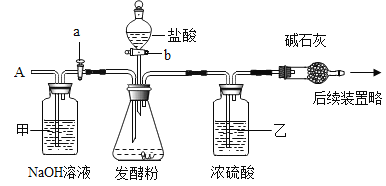
[查阅资料] 碱石灰是氧化钙和氢氧化钠固体的混合物。
[实验步骤]
①取50g样品于锥形瓶中,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气;
②关闭活塞a,打开活塞b,加入足量的稀盐酸,直至锥形瓶内不再产生气泡;
③关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气,直至干燥管内物质质量不再增加;
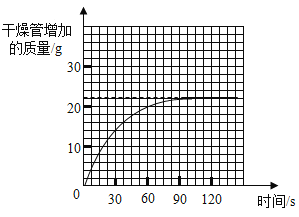
④测量干燥管增加的质量与时间关系(见曲线图)。
(1)步骤①加入样品前还应___________________。
(2)装置乙的作用是_________________________。
(3)步骤③鼓入一定量空气的目的是_________________________________。
(4)若缺少装置甲,将导致结果_________(选填“偏大”、“偏小”或“不变”)。
(5)实验测得干燥管增加的质量与时间关系(见曲线图),涉及反应的方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。请回答:
①生成二氧化碳的质量为_______g。
②该样品中碳酸氢钠的质量分数。(写出计算过程)______。
(6)[拓展应用]
①碳酸氢钠、氢氧化镁、氢氧化铝等常用于制作抗酸药,用来治疗胃酸过多。但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠,其原因是____________________。
②实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,你能否设计一个实验进行鉴别,请简述你的实验方案、现象和结论______________________________________________。
【题目】煤是当前热电厂发电的主要燃料,燃煤烟气大量排放对大气环境带来较大影响。为改善空气质量,并将烟气中的二氧化硫转化为副产品石膏,简易流程如图:
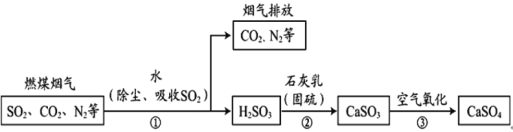
(1)写出流程②中发生反应的化学方程式:_____。
(2)流程③中通入空气发生的化学反应方程式_____,基本反应类型为_____。
(3)“绿水青山就是金山银山”,为减少污染改善环境状况,该公司决定将煤电厂改造成燃气发电厂,下表是几种气体燃料的价格和热值:
燃烧物 | 煤气 | 液化石油气 | 天然气 |
价格 | 1.4元/Kg | 6.0元/kg | 1.8元/kg |
热值 | 1.56×104KJ/Kg | 4.5×104KJ/kg | 3.9×104KJ/kg |
除了环保因素外,综合考虑,你将选用的燃料是_____,理由_____。
【题目】化学兴趣A组的同学们利用废硫酸液制备K2SO4,设计的流程如下图所示:
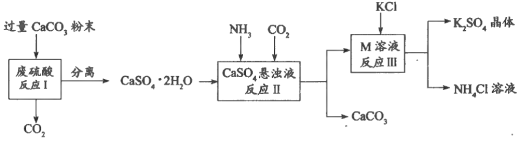
(1)写出反应Ⅰ的化学方程式:___________________________________________。
(2)反应Ⅱ生成了一种可用作氮肥的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_____________________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是___________________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是_____________;为了检验此晶体是否洗涤干净,常取最后一次洗涤液于试管中,先加入过量的_____________(选填字母),振荡、静置, 再向上层清液中滴加_____________(选填字母),观察现象即可判断该晶体是否洗涤干净。
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液
D Ba(OH)2溶液 E NaOH溶液 F KOH溶液