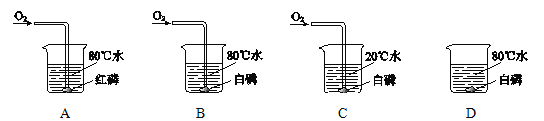
题目内容
【题目】以下是日常生活中常用的几种清洗剂,请回答:
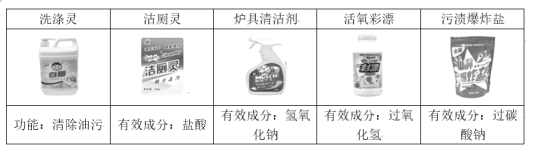
(1)清除以下物质,可使用炉具清洁剂的是_______(填标号)。
a 铁锈 b 油污 c 水垢
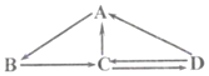
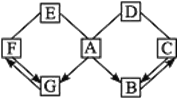
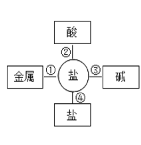
(2)污渍爆炸盐溶于水后生成Na2CO3和H2O2,再加入足量洁厕灵,产生能使澄清石灰水变浑浊的气体。产生该气体的反应体现了下图中________(选填“①”、“②”、“③”或“④”)的性质关系。
(3)如下图甲所示,将洁厕灵滴入炉具清洁剂中。
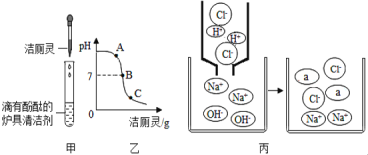
①发生反应的化学方程式为_________________________________________________________,该反应属于_______________(填基本反应类型)。
②若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_______________,此时溶液可用图乙中__________(选填“A”、“B”或“C”)点处表示。
③若反应后溶液pH为7,图丙中a微粒的化学式为__________。
④下列试剂不能验证出反应后溶液处于图乙中C点的是________(填标号)。
a pH试纸 b 铜粉 c 氧化铁 d 氢氧化铜 e 碳酸钙 f 硝酸银溶液
【答案】b ② HCl+NaOH=NaCl+H2O 复分解反应 氯化钠和氢氧化钠 A H2O bf
【解析】
(1)炉具清洁剂能和油污反应;
(2)根据所学知识知道碳酸钠和盐酸反应生成氯化钠、水、二氧化碳气体,此反应体现了图1中②性质关系;
(3)①盐酸和氢氧化钠反应生成氯化钠和水,发生反应的化学方程式为:HCl+NaOH=NaCl+H2O;该反应属于复分解反应;
②氢氧化钠溶液呈碱性,而酚酞遇碱变红色,所以将酚酞滴入溶液变为红色,说明反应过程中,氢氧化钠有剩余,故此时溶质为氯化钠和氢氧化钠;此时溶液可用如图2乙中的A点表示;
③氢氧化钠可以和稀盐酸反应生成氯化钠和水,反应方程式为:HCl+NaOH=NaCl+H2O;而氯化钠在溶液中以钠离子和氯离子的形式存在,结合图中信息可以知道a为水;化学式为:H2O;
④氢氧化钠可以和稀盐酸反应生成氯化钠和水,C点pH小于7,显酸性,则溶液中含有氯化氢、氯化钠,由此可知:
a、用pH试纸测该溶液的酸碱度,若小于7,证明有盐酸,故正确;
b、铜不与盐酸和氯化钠反应,不会有明显现象,故错误;
c、氧化铁与盐酸反应生成氯化铁和水,溶液由无色变成黄色,而与氯化钠不反应,故正确;
d、氢氧化铜与盐酸反应生成氯化铜和水,溶液由无色变成蓝色,而与氯化钠不反应,故正确;
e、碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,溶液中有气泡产生,而与氯化钠不反应,故正确;
f、硝酸银溶液与盐酸和氯化钠都能反应生成氯化银白色沉淀,故错误。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】发酵粉的主要成分中含有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行如下探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
(1)用pH试纸测得碳酸氢钠溶液的pH约为9,可知碳酸氢钠溶液________性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料] 碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
[实验1] 如图所示,取一定量的碳酸氢钠放到铜片上加热。

(2)加热一段时间后,观察到烧杯内壁产生___________(填现象)。
(3)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是______________。
(4)欲通过实验探究进一步确定充分加热后的固体产物的成分。
猜想1:可能是NaOH;猜想2:可能是Na2CO3;猜想3:可能是NaOH和Na2CO3。
实验2:
实验操作(步骤) | 实验现象 | 实验结论 |
①将该固体溶于水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸 | 有气体产生 | 猜想_______不成立 |
②另取少量溶液于试管中,滴加_____ | _____ | 固体产物中含Na2CO3 |
③取步骤②所得上层清液,滴加_____ | 无明显现象 | 猜想2成立 |
[实验结论]
(5)NaHCO3受热易分解,反应化学方程式为_________________________________________。
Ⅱ.定量探究
为测定某发酵粉中碳酸氢钠的质量分数(发酵粉中其他组分不参与反应),设计了如下实验。
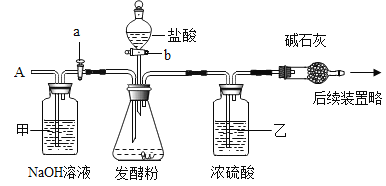
[查阅资料] 碱石灰是氧化钙和氢氧化钠固体的混合物。
[实验步骤]
①取50g样品于锥形瓶中,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气;
②关闭活塞a,打开活塞b,加入足量的稀盐酸,直至锥形瓶内不再产生气泡;
③关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气,直至干燥管内物质质量不再增加;
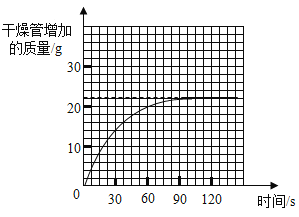
④测量干燥管增加的质量与时间关系(见曲线图)。
(1)步骤①加入样品前还应___________________。
(2)装置乙的作用是_________________________。
(3)步骤③鼓入一定量空气的目的是_________________________________。
(4)若缺少装置甲,将导致结果_________(选填“偏大”、“偏小”或“不变”)。
(5)实验测得干燥管增加的质量与时间关系(见曲线图),涉及反应的方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。请回答:
①生成二氧化碳的质量为_______g。
②该样品中碳酸氢钠的质量分数。(写出计算过程)______。
(6)[拓展应用]
①碳酸氢钠、氢氧化镁、氢氧化铝等常用于制作抗酸药,用来治疗胃酸过多。但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠,其原因是____________________。
②实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,你能否设计一个实验进行鉴别,请简述你的实验方案、现象和结论______________________________________________。
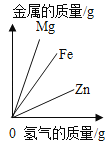
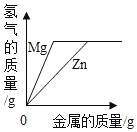
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D