��Ŀ����
����Ŀ��ij��ѧ��ȤС����ù�������ֽ�����ˮ��������ʵ����������̽����
��������⣩��Щ���ؿ���Ӱ��÷�Ӧ�ķ�Ӧ���ʣ�
���������ϣ�Ӱ�컯ѧ��Ӧ���ʵ����أ�
����Ҫ���أ���Ӧ�ﱾ�������ʣ�
��������أ��¶ȣ�Ũ�ȣ�ѹǿ���������⣬���⣬��Ӧ�������С����Ӧ��֮��ĽӴ�����ͷ�Ӧ��״̬��
�����⣬x���ߣ�������Ҳ��Ӱ�컯ѧ��Ӧ���ʡ�
���������룩������С������λͬѧ�����IJ��룬�������С���IJ��롣
С��ͬѧ��H2O2��Һ��Ũ�ȿ���Ӱ��÷�Ӧ�ķ�Ӧ���ʡ�
С��ͬѧ��������MnO2������������Ӱ��÷�Ӧ�ķ�Ӧ���ʣ�
С��ͬѧ������Ϊ��1��_____����Ӱ��÷�Ӧ�ķ�Ӧ���ʡ�
��ʵ����֤��
��2��С��ͬѧ��ʵ���ǣ�ÿ�ξ�ȡ10mL30%��H2O2��Һ��Ȼ��ϡ�ͳɲ�ͬŨ�ȵ���Һ����ʵ�飬�ⶨ�����ռ���100mL����ʱ���õ�ʱ�䣬��¼���������������ʵ���������¶ȡ����������Ⱦ���ͬ��
ʵ����� | 1 | 2 | 3 | 4 | 5 |
H2O2��ҺŨ�� | 1% | 5% | 15% | 25% | 30% |
����ʱ�䣨�룩 | 660 | 205 | 25 | 4 | 3 |
��������ش�H2O2��Һ��Ũ�ȶԹ�������ֽ���������Ӧ������ʲôӰ�죿_____
��3��С��ͬѧ��ʵ���ǣ�ÿ�ξ���30mL10%��H2O2��Һ�����ò�ͬ��MnO2��ĩ���������ⶨ�����ռ���500mL����ʱ���õ�ʱ�䣬��������������ʵ������������������ҺŨ�ȡ��¶ȵȾ���ͬ��
ʵ����� | 1 | 2 | 3 | 4 | 5 |
MnO2��ĩ�������ˣ� | 0.2 | 0.4 | 0.6 | 0.8 | |
����ʱ�䣨�룩 | 8 | 5 | 3 | 2 | 2 |
��������ش𣺸÷�Ӧ�Ļ�ѧ����ʽΪ_____������MnO2�������Թ�������ֽ���������Ӧ������ʲôӰ�죿_____
��4���������С��ͬѧ������֤��IJ���ʱ�����ʵ�鷽���ǣ�_____��
���𰸡��¶ȣ���������������������𰸾��ɣ� H2O2��Һ��Ũ��Խ��Ӧ����Խ�� 2H2O2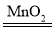 2H2O+O2�� ��һ����Χ�ڣ�������MnO2��������Խ�࣬��Ӧ����Խ�� �ֱ���20�桢40�������£����Ũ�ȡ�������Ĺ���������Һ�У�����������Ķ������̷�ĩ���������ռ�һƿ�������������Ҫ��ʱ��(���������𰸾���)
2H2O+O2�� ��һ����Χ�ڣ�������MnO2��������Խ�࣬��Ӧ����Խ�� �ֱ���20�桢40�������£����Ũ�ȡ�������Ĺ���������Һ�У�����������Ķ������̷�ĩ���������ռ�һƿ�������������Ҫ��ʱ��(���������𰸾���)
��������
��1������֪���Ͽ�֪��Ӱ�컯ѧ��Ӧ���ʵ���������������ʿɲ����¶ȣ�ѹǿ����ȣ�
��2���ɼ�¼�����ݱ���֪��H2O2��Һ��Ũ��Խ��Ӧ����Խ�죻
��3��˫��ˮ�ֽ�Ļ�ѧ����ʽΪ2H2O2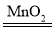 2H2O+O2����������¼���ݱ���֪����Ӧ���ʲ������Ŵ������������Ӷ������Ƽӿ죬������һ����Χ�ڣ�����������Խ�࣬��Ӧ����Խ�죻
2H2O+O2����������¼���ݱ���֪����Ӧ���ʲ������Ŵ������������Ӷ������Ƽӿ죬������һ����Χ�ڣ�����������Խ�࣬��Ӧ����Խ�죻
��4�����¶���ÿ��ƣ���ʵ��һ����ƽ����¶ȵ�ʵ�飬ʵ�鷽��Ϊ���ֱ���20�桢40�������£����Ũ�ȡ�������Ĺ���������Һ�У�����������Ķ������̷�ĩ���������ռ�һƿ�������������Ҫ��ʱ�䡣