题目内容
【题目】请根据下列装置,回答问题:
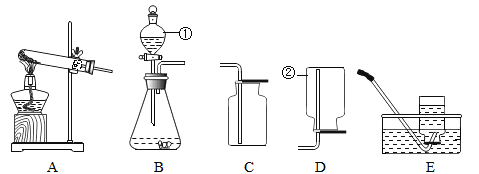
(1)写出图中标号仪器的名称:①_____;②_____。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气时,发生装置选用_____(填装置序号);收集装置选用_____(填装置序号)。
(3)安装好装置后,先_____,再装药品。
(4)一氧化氮在常温下是一种难溶于水的气体,密度比空气略大,能跟空气中的氧气迅速反应,生成二氧化氮。要收集一氧化氮气体,收集装置选用_____(填装置序号)。
【答案】分液漏斗 集气瓶 B C或E 检查装置气密性 E
【解析】
解:(1)图中标号仪器的名称:①是分液漏斗;②是集气瓶;
(2)实验室用过氧化氢制取氧气的反应物是固体和液体,反应条件是常温,故发生装置选B;氧气密度比空气大,不易溶于水,所以可用向上排空气法或排水法收集;
(3)安装好装置后,先检查装置气密性,再装药品;
(4)由于一氧化氮在常温下是难溶于水的气体,密度比空气略大,它能跟空气中的氧气迅速反应,生成红棕色的二氧化氮气体.若要收集一氧化氮气体,可以采用的方法是排水法收集。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某化学兴趣小组对用过氧化氢分解生成水和氧气的实验条件进行探究。
(提出问题)哪些因素可能影响该反应的反应速率?
(查阅资料)影响化学反应速率的因素:
①主要因素:反应物本身的性质;
②外界因素:温度,浓度,压强,催化剂,光,激光,反应物颗粒大小,反应物之间的接触面积和反应物状态;
③另外,x射线,γ射线也会影响化学反应速率。
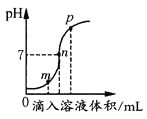
(作出猜想)下面是小组内三位同学所做的猜想,请你完成小丽的猜想。
小红同学:H2O2溶液的浓度可能影响该反应的反应速率。
小明同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
小丽同学:我认为(1)_____可能影响该反应的反应速率。
(实验验证)
(2)小红同学的实验是:每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次收集到100mL氧气时所用的时间,记录数据如表:(其他实验条件:温度、催化剂用量等均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 |
H2O2溶液浓度 | 1% | 5% | 15% | 25% | 30% |
所用时间(秒) | 660 | 205 | 25 | 4 | 3 |
请你分析回答:H2O2溶液的浓度对过氧化氢分解制氧气反应速率有什么影响?_____
(3)小明同学的实验是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如表:(其他实验条件:过氧化氢溶液浓度、温度等均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 |
MnO2粉末用量(克) | 0.2 | 0.4 | 0.6 | 0.8 | |
所用时间(秒) | 8 | 5 | 3 | 2 | 2 |
请你分析回答:该反应的化学方程式为_____;催化剂MnO2的用量对过氧化氢分解制氧气反应速率有什么影响?_____
(4)如果你是小丽同学,在验证你的猜想时,你的实验方案是:_____。
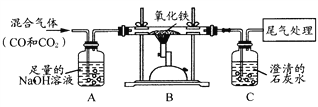
【题目】下列装置用于实验室中CO2的制备、净化、检验,最后收集一瓶干燥的CO2。请回答下列问题:
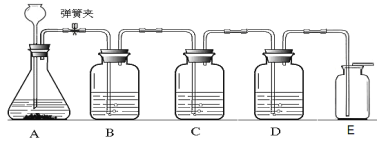
(1)对实验室制取二氧化碳药品选择的探究实验,记录如下:
组别 | 药品 | 实验现象 |
① | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
从制取和收集的角度分析,一般选择第____________(填序号)组药品,所发生反应的化学方程式为_______________________。
(2)C装置用于检验二氧化碳气体,则C中所盛放的物质是___________________,发生反应的化学方程式是_____________________。
(3)反应过程中将弹簧夹关闭,在A中观察到的现象是__________________________。
(4)E收集方法说明二氧化碳具有的物理性质是________________________________。