题目内容
【题目】某化学探究小组为了验证铁、铜、锌、银的金属活动性顺序,设计了如下实验方案:
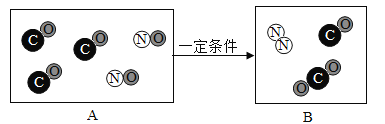
①将铁片加入到稀盐酸中 ②将铜片加入到硝酸银溶液中 ③将锌片加入到稀盐酸中 ④将金属片X加入到Y中。(所有金属均已打磨,且形状、大小以及稀盐酸浓度均相同)
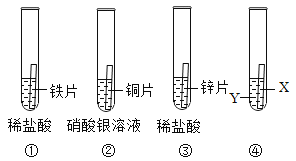
(1)写出①中反应的化学方程式:_____________________;
(2)通过上述实验,可以判断锌的金属活动性比铁强,依据的现象是_______________________;
(3)要得出这四种金属的活动性顺序,如果④中Y表示硫酸铜溶液,则X表示的一种金属是________。
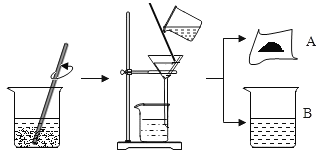
(4)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题。某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂CaO的棉花并塞上橡皮塞。
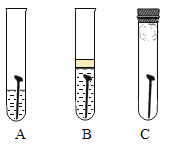
在三支试管中,容易生锈的是_________中的铁钉,因此铁生锈的条件是:___________________。
【答案】Fe + 2HCl = FeCl2 + H2↑ ③中反应速率比①中快 Fe A 铁与水和氧气同时接触
【解析】
(1)铁与稀盐酸反应生成氯化亚铁和氢气,所以①中反应的化学方程式为:Fe + 2HCl = FeCl2 + H2↑;
(2)根据③中反应速率比①中快,可判断出锌的金属活动性比铁强。
(3)根据①②③中的实验现象可知,Zn>Fe,Cu>Ag,要验证铁、铜、锌、银的金属活动性顺序,必须要探究出Fe、Cu的金属活动性顺序,如果④中Y表示硫酸铜溶液,则X是Fe。
(4)在三支试管中,容易生锈的是A中的铁钉,因此铁生锈的条件是:铁与水和氧气同时接触。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案