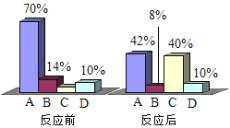
题目内容
【题目】Q同学将装有硫酸镁和硫酸铜废液的烧杯中,放入一定量的铁粉,搅拌,待充分反应后过滤、洗涤,得到固体A和溶液B,操作步骤如图所示。请你与小组同学共同完成以下探究:
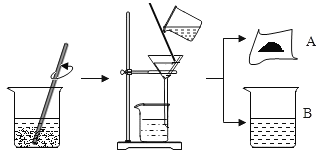
加入铁粉时一定发生反应的化学方程式为___________________________
探究实验1(提出问题)滤液中的溶质成分?
(猜想与假设) 超超同学:MgSO4 楠楠同学:FeSO4、MgSO4 鹍鹍同学:……
(表达交流)若鹍鹍同学猜想合理,则她的猜想是_______________________
(反思评价)请你评价超超同学的猜想_________________________________
(归纳总结)确定合理猜想的方法是:与所加物质反应后生成的溶于水的物质一定存在;与所加物质_________的溶质一定存在;与所加物质发生反应的溶质可能存在。
探究实验2(提出问题)固体A中的成分是什么?
(进行实验)取少量固体于试管中,加入少量稀盐酸,观察到的现象是__________ ; 得出固体成分为Fe、Cu.
(表达交流)在得出固体A的成分后,也确定了溶液B中溶质的成分为(填化学式)______________。
(归纳总结)在此探究实验中:根据上述探究确定固体A成分实验后,也可以确定溶液B合理猜想的对与错,依据原理是合理猜想的溶质成分能与_______________的猜想是错误的,从而确定了溶质的成分。
【答案】![]() CuSO4、FeSO4、MgSO4 不正确,加入铁粉后一定与硫酸铜溶液反应生成可溶于水的硫酸亚铁一定存在,所以错误(或硫酸亚铁是溶于水的生成物一定存在) 不发生反应 固体表面有气泡产生 MgSO4、FeSO4 固体A中物质发生反应
CuSO4、FeSO4、MgSO4 不正确,加入铁粉后一定与硫酸铜溶液反应生成可溶于水的硫酸亚铁一定存在,所以错误(或硫酸亚铁是溶于水的生成物一定存在) 不发生反应 固体表面有气泡产生 MgSO4、FeSO4 固体A中物质发生反应
【解析】
根据铁能与硫酸铜反应生成硫酸亚铁和铜分析;
[猜想与假设]根据滤液中的溶质可能有硫酸镁和硫酸铜、硫酸亚铁分析;
[反思评价]根据铁一定能与硫酸铜反应生成硫酸亚铁,且硫酸亚铁溶于水分析;
[归纳总结]根据确定合理猜想的方法分析;
[进行实验]根据固体成分中有Fe时,一定能与稀盐酸反应生成氢气分析;
[表达交流]根据若铁有剩余时,则溶液中一定不再有硫酸铜分析;
[归纳总结]根据固体A中的成份不能与FeSO4、MgSO4反应分析;
铁能与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:![]() ;
;
[猜想与假设]铁能与硫酸铜反应生成硫酸亚铁和铜,若铁的量不足,则滤液中的溶质有硫酸镁和硫酸铜、硫酸亚铁,若铁的量足够,则硫酸铜完全反应掉,滤液中只会有硫酸镁和硫酸亚铁;由于楠楠同学猜想滤液中有FeSO4、MgSO4;则鹍鹍同学可猜想滤液中的溶质有硫酸镁和硫酸铜、硫酸亚铁;
[反思评价]超超同学的猜想不正确,因为铁一定能与硫酸铜反应生成硫酸亚铁,且硫酸亚铁溶于水;
[归纳总结]确定合理猜想时要注意,一是与所加物质反应后生成的溶于水的物质一定存在;二是与所加物质不发生反应的溶质一定存在;三是与所加物质发生反应的溶质可能存在,根据实验现象分析可能性;
[进行实验]固体成分中有Fe时,一定能与稀盐酸反应生成氢气,所以会在固体表面产生气泡;
[表达交流]确定固体A的成份为Fe、Cu后,可知铁有剩余,则证明硫酸铜完全反应,溶液中一定不再有硫酸铜;
[归纳总结]固体A中的成份为Fe、Cu,它们都不能与FeSO4、MgSO4反应,所以可证明溶液的成份。

 阶梯计算系列答案
阶梯计算系列答案【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用15 g石灰石样品,把50g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 10g | 20g | 30g | 40g | 50g |
剩余固体的质量 | 12g | 9g | 6g | 5g | 5g |
请计算:
(1)石灰石中碳酸钙的质量分数为_______?
(2)最终生成二氧化碳的质量是______?