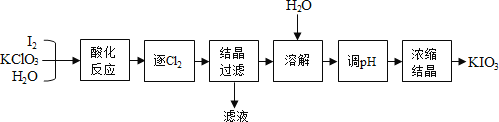
题目内容
【题目】除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是( )
A. KCl 固体(KClO3)——加入少量的二氧化锰,并加热
B. CuO 固体(Cu)——在氧气流中充分加热
C. HCl 气体(H2)——通过足量的氢氧化钠溶液,并干燥
D. Na2SO4溶液(Na2CO3)——加入适量的 Ca(OH)2溶液,过滤
【答案】B
【解析】
除杂要求:不引入新的杂质,不能和原物质反应。
A、![]() 固体(
固体(![]() ),加入少量的二氧化锰,并加热,
),加入少量的二氧化锰,并加热,![]() 分解生成
分解生成![]() 和氧气,二氧化锰反应前后质量不变,引入了二氧化锰杂质,故A不正确;
和氧气,二氧化锰反应前后质量不变,引入了二氧化锰杂质,故A不正确;
B、![]() 固体(
固体(![]() ),在氧气流中充分加热,铜和氧气生成氧化铜,除去了铜,故B正确;
),在氧气流中充分加热,铜和氧气生成氧化铜,除去了铜,故B正确;
C、![]() 气体(
气体(![]() ),通过足量的氢氧化钠溶液,
),通过足量的氢氧化钠溶液,![]() 和氢氧化钠反应,除去了原物质,故C不正确;
和氢氧化钠反应,除去了原物质,故C不正确;
D、![]() 溶液(
溶液(![]() ),加入适量的
),加入适量的![]() 溶液,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,引入了氢氧化钠杂质,故D不正确。故选B。
溶液,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,引入了氢氧化钠杂质,故D不正确。故选B。

【题目】某校化学兴趣小组进行了甲、乙两个实验。
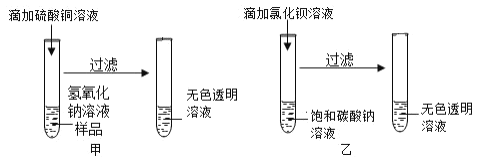
(1)甲实验中反应的化学方程式为_____;
(2)乙实验观察到的现象是_____。
(3)实验结束后,小组同学把实验后的两支试管的溶液倒入同一个烧杯中,发现烧杯中仅得到无色溶液,他们决定对烧杯中溶液的溶质成分进行探究。
(提出问题)烧杯中溶液的溶质成分是什么?
一致认为认为溶液的溶质一定有Na2SO4和_____;溶质中还可能有什么?
(进行猜想)小明认为烧杯中溶液的溶质可能有NaOH,小亮认为烧杯中溶液的溶质可能有_____;小红认为烧杯中溶液的溶质可能有Na2CO3和NaOH。
(验证猜想)
实验操作 | 现象 | 结论 |
①取少量烧杯中的溶液于试管,测定pH. | pH>7 | 溶液呈_____性 |
②另取少量烧杯中的溶液于试管中,滴加足量BaCl2溶液,静置,再滴加无色酚酞。 | _____, 溶液由无色变为红色。 | 小红的猜想成立 |
(结论分析)小刚认为实验操作②的结论不严谨,因为_____(用文字表述);若要确定小红的猜想是否成立,应另取少量烧杯中的溶液于试管中,滴加_____,然后观察是否有_____出现,反应的方程式为_____。
(拓展与思考)如果实验操作①中测得的pH=7,烧杯中溶液的溶质成分是_____;
可见,探究反应后所得物质的成分时,既要考虑生成物,还要考虑反应物是否过量。
(综合计算)向50g硫酸铜溶液中,逐滴加入NaOH溶液,加入NaOH溶液的质量与生成沉淀的质量之间的关系如图所示,请回答下列问题:
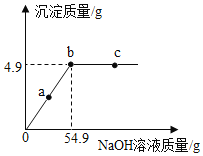
(1)恰好完全反应时,溶液的质量为_____g。
(2)求原硫酸铜溶液中溶质的质量分数_____(写出计算过程)。
(3)在实验过程中,以下说法正确的是_____。
A 0至b段溶液中溶质质量逐渐增加
B a、b、c点对应的溶液中溶质均为一种
C 向c点对应的溶液中滴加酚酞溶液,溶液变红
D 整个过程中,溶液中氢元素的质量一直在增加
【题目】金属锰(Mn)及其化合物用途广泛。铁锰合金(锰钢)可用作大型体育场馆的网封架屋顶材料、铁轨、桥梁等。部分锰的化合物的颜色及溶解性见下表,回答下列问题。
物质 | KMnO4 | MnO2 | MnSO4 | Mn(OH)2 | MnO(OH)2 |
颜色 | 暗紫色 | 黑色 | 白色 | 白色 | 棕色 |
溶解性 | 易溶 | 难溶 | 易溶 | 难溶 | 难溶 |
(1)KMnO4读作______________,广泛用作医药杀菌剂和防臭剂。
(2)将适当比例的铁矿石(Fe2O3)、软锰矿(MnO2)、焦炭混合加入高炉,通入热空气熔炼,可得到铁锰合金。用化学方程式表示生成金属锰的过程:
①C + O2![]() CO2;② _______________________;③ ________________________。
CO2;② _______________________;③ ________________________。
(3)已知:①MnSO4+2NaOH=Mn(OH)2↓+Na2SO4; ②2Mn(OH)2+O2=2MnO(OH)2 若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是______________。