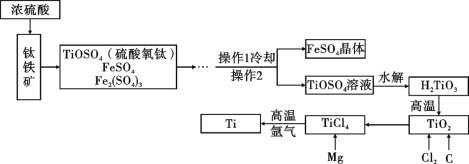
题目内容
【题目】把干燥的高锰酸钾固体50g装入大试管中,加热制取氧气.待反应一段时间后停止加热,将试管冷却,称量得剩余物质的质量为45.2g.计算
(1)反应后生成多少克氧气?
(2)45.2g剩余物质中含有哪些物质?各是多少?
【答案】(1)4.8g;(2)含有高锰酸钾、锰酸钾、二氧化锰;高锰酸钾的质量是2.6g,锰酸钾的质量为29.55g,二氧化锰的质量为13.05g
【解析】
(1)由质量守恒定律可知氧气的质量=50g﹣45.2g=4.8g;
(2)设:参加反应的KMnO4质量为x,反应生成的K2MnO4质量为y、MnO2质量分别为z。
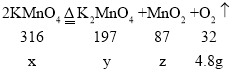
![]() x=47.4g
x=47.4g
![]() y=29.55g
y=29.55g
![]() z=13.05g
z=13.05g
剩余的高锰酸钾的质量=50g﹣47.4g=2.6g。
答:(1)反应中出生成4.8g氧气;
(2)45.2g剩余物质中含有高锰酸钾、锰酸钾、二氧化锰;其中剩余固体中高锰酸钾的质量是2.6g,锰酸钾的质量为29.55g,二氧化锰的质量为13.05g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目