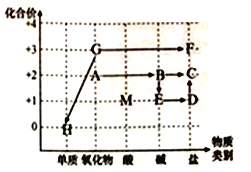
��Ŀ����
����Ŀ��ij����С���һʪ��ұͭ���ŷŵķ�ˮ�к������������ͭ������Ⱦ�Ϊ�ⶨ�÷�ˮ�и���Ⱦ��ĺ�������ұͭ���ṩ������ˮ�IJο�������С���ͬѧ����������ʵ�顣ȡ��ˮ200g�������м���������������Ϊ20%������������Һ��������ɳ����������������������������Һ��������ϵ���±���
���������������Һ������/g | 40 | 80 | 120 | 160 |
���ɳ���������/g | 0 | 9.8 | 19.6 | 19.6 |
�����������ݷ����ͼ��㣺
��1����200g�÷�ˮ�м�������������������Һ��������������Ϊ_____g��
��2��200g�÷�ˮ������ͭ��������������_____��
��3��200g�÷�ˮ���������������Ϊ_____g��
��4����ȡͬ����200g�÷�ˮ�������м���17.1%��Ba(OH)2��Һ�����㻭������Ba(OH)2��Һ����������������������Ĺ�ϵͼ��_____������������ͼ������������۵�����꣩
���𰸡�19.6 16% 9.8 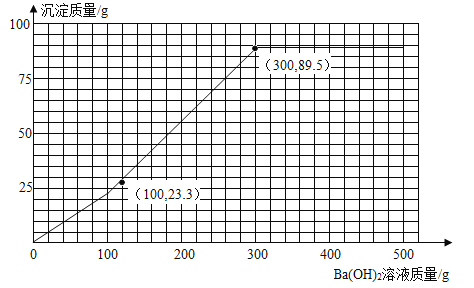
��������
����ͭ���������Ʒ�Ӧ���������ƺ�������ͭ��������������Ʒ�Ӧ���������ƺ�ˮ�����������������Ӧ�������ᱵ��ˮ������ͭ������������Ӧ�������ᱵ������������ͭ������
��1�������ɳ����������������������������Һ��������ϵ����֪�����������������Һ������Ϊ120g��160g�����ɳ�����������Ϊ19.6g��������������Һ������Ϊ120gʱ����Ӧ��ȫ�����ɳ����������ﵽ���ֵ������200g�÷�ˮ�м�������������������Һ��������������Ϊ19.6g��
��2����200g��ˮ������ͭ������Ϊx

![]()
![]()
�ʷ�ˮ������ͭ��������������Ϊ![]() ��
��
��3���ɱ������ݿ�֪��ÿ40g����������Һ������ͭ��Ӧ���ɳ���9.8g��ǰ40g����������Һ�����ᷴӦ��
���ˮ�����������Ϊy

![]()
![]()
��200g�÷�ˮ���������������Ϊ9.8g��
��4�����Һ��������Ba(OH)2��Һǡ�÷�Ӧ�������ᱵ������Ϊn������Ba(OH)2��Һ����m
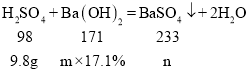
![]()
![]()
���Һ������ͭ��Ba(OH)2��Һǡ�÷�Ӧ�������ᱵ������Ϊa������������ͭ������Ϊb������Ba(OH)2��Һ������c

![]()
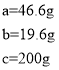
���Һ�����������ͭ��Ӧ��ȫʱ�����ɳ���Ϊ![]() ������Ba(OH)2��Һ����Ϊ
������Ba(OH)2��Һ����Ϊ![]() ������Ba(OH)2��Һ����������������������Ĺ�ϵͼΪ
������Ba(OH)2��Һ����������������������Ĺ�ϵͼΪ
 ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijʳƷ��װ���ϵ�˵�����£�
��Ʒ���� | XX���� |
���� | С��ɰ�ǡ�����ֲ���͡��ʼ��������͡�ʳ�Ρ����ɼ���ʳ���㾫 |
��� | 400g |
���ط��� | �����������ˬ������������ֱ�� |
������ | 270�� |
�������� | XXXX��XX��XX�� |
��1�������ֱ��ɵ������У����������ʵ���______________��������֬����_____________�������ǣ�C6H12O6����������֯����ø�Ĵ������·�����Ӧ�Ļ�ѧ����ʽΪ________________��
��2����֪�������к�N����������ԼΪ15%������һ�������˴�ʳ������ȡ�ĵ����ʾ��������³´�л����ȫת��Ϊ����CO(NH2)2�ų����⣬ÿ���ų�����25g�����������ÿ���ʳ������ȡ�ĵ����ʵ�����������________g���г���ʽ���ɣ���