题目内容
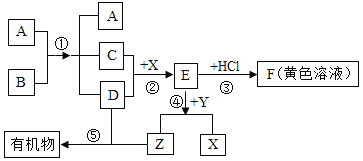
【题目】A﹣G是初中化学的常见物质.其中,A是农药“波尔多液”的成分之一,C是红色金属,E是蓝色沉淀.如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.
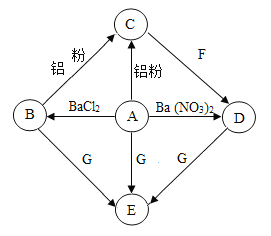
(1)请写出化学式:A______,E______.
(2)写出A→C的化学方程式:______.
(3)在B→C的反应过程中,溶液质量______(填“增加”、“不变”或“减少”).
(4)C与F的溶液反应后得到固体和溶液,取溶液于试管中加入盐酸,无白色沉淀生成,则得到的固体中一定有______(填化学式,下同),可能有______.
【答案】CuSO4 Cu(OH)2 2Al+3CuSO4=3Cu+Al2(SO4)3 减少 Ag Cu
【解析】
根据“A是农药“波尔多液”的成分之一”,则推测A中含有铜离子,A可以和氯化钡、硝酸钡反应,则A是硫酸铜,E为氢氧化铜沉淀,B是氯化铜,D是硝酸铜;根据“C是红色金属”,则推测C为铜;铜和硝酸银反应生成硝酸铜,则推测F为硝酸银溶液,代入验证,符合题意。
(1)根据分析可知,A是硫酸铜,化学式为CuSO4,E是氢氧化铜,化学式Cu(OH)2;
(2)反应A→C,即铝与硫酸铜溶液反应生成铜和硫酸铝,化学方程式:2Al+3CuSO4=3Cu+Al2(SO4)3;
(3)在B→C的反应,即氯化铜溶液与铝反应,其化学方程式:3CuCl2+2Al=3Cu+2AlCl3,每54份质量的铝生成192份质量的铜从溶液中析出,故过程中溶液质量减少;
(4)根据C与F的溶液反应,即铜与硝酸银溶液反应后得到固体银和硝酸铜溶液,取溶液于试管中加入盐酸,无白色沉淀生成,则说明无硝酸银了,故得到的固体中一定有银,可能有铜。

【题目】某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验。取废水200g,向其中加入溶质质量分数为20%的氢氧化钠溶液。测得生成沉淀的质量与所加入的氢氧化钠溶液的质量关系如下表:
加入的氢氧化钠溶液的质量/g | 40 | 80 | 120 | 160 |
生成沉淀的质量/g | 0 | 9.8 | 19.6 | 19.6 |
根据所得数据分析和计算:
(1)向200g该废水中加入足量的氢氧化钠溶液产生沉淀的质量为_____g。
(2)200g该废水中硫酸铜的溶质质量分数_____。
(3)200g该废水中硫酸的溶质质量为_____g。
(4)另取同样的200g该废水,向其中加入17.1%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。_____(在坐标中作图,并标出曲线折点的坐标)
【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如表:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
下列说法正确的是( )
A.反应后X的质量为1.4g
B.X中一定含有碳元素和氢元素
C.X中一定含有碳元素和氧元素
D.X中两种元素的质量比为1:1