题目内容
(6分)把6.5g 锌放入到50g 硫酸溶液恰好完全反应。计算:
可制得氢气多少克?
这种硫酸溶液中溶质的质量分数是多少?
①0.2g②19. %
解析试题分析:(1)根据题意可知:已知量为锌的质量;未知量为氢气的质量和硫酸溶液的溶质质量分数。解题思路:可根据锌与硫酸、氢气在反应过程中的质量关系进行求解。具体过程如下:
解:设可制得氢气的质量为x,得到硫酸锌的质量为y
Zn + H2SO4 ="===" ZnSO4+ H2↑
65 98 2
6.5g y x
65:2=6.5g:x
x=0.2g
65:98=6.5g:y
y=9.8g
(2)这种硫酸溶液中溶质的质量分数: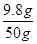 ×100%=19.6%
×100%=19.6%
答:①可制得氢气0.2g;②硫酸溶液中溶质的质量分数是19.6%
考点:根据化学方程式的计算、溶质质量分数的计算

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
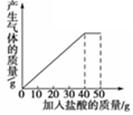
请计算:
(1)石灰石样品中杂质的质量为 g。
(2)所加盐酸的溶质质量分数.
(5分)某石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
| 次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 稀盐酸的用量 | 5 g | 5 g | 5g | 5g |
| 剩余固体的质量 | 3 g | 2 g | 1 g | 1 g |
(2)列出4 g石灰石完全反应生成的二氧化碳质量(x)的比例式_________________;
(3)该稀盐酸的溶质质量分数为___________;
(4)向第二次反应结束后的溶液中加入8.88 g水,所得不饱和溶液的溶质质量分数为___________;
(5)若要配制20 g上述稀盐酸需要36.5%的浓盐酸和水的质量比为________________。
(8分)石灰石的主要成分为CaCO3(其余杂质不溶于水,亦不参加反应)。某化学兴趣小组为了测定石灰石中CaCO3的质量分数,进行了以下探究实验:称石灰石样品二份,分别放入大烧杯中,第一个烧杯中加入50克稀盐酸,第二个烧杯中放入100克稀盐酸,充分反应至不再有气泡产生时称量残留物质量,有关数据如下表。求:(1)二个烧杯中CO2的质量;(2)石灰石样品中CaCO3的质量分数;(3)稀盐酸中溶质的质量分数。
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 样品质量 | 16g | 16 g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 61.6 g | 109.4g |
| 产生的CO2质量 | | |
(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
