题目内容
(3分)为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
(1)100g;(2)80%
解析试题分析:
设:样品中杂质的质量为x,反应消耗盐酸的为y;生成二氧化碳的质量为
CaCO3 + 2HCl ==== CaCl 2 + CO2↑ + H2O
100 73 111
25g-x 14.6%y 27.2g-x
X="5g"
y=100g
CaCO 3% = 
答:样品中碳酸钙的含量为80%,反应消耗盐酸的为100g
考点:根据化学方程式的计算

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
(8分)石灰石的主要成分为CaCO3(其余杂质不溶于水,亦不参加反应)。某化学兴趣小组为了测定石灰石中CaCO3的质量分数,进行了以下探究实验:称石灰石样品二份,分别放入大烧杯中,第一个烧杯中加入50克稀盐酸,第二个烧杯中放入100克稀盐酸,充分反应至不再有气泡产生时称量残留物质量,有关数据如下表。求:(1)二个烧杯中CO2的质量;(2)石灰石样品中CaCO3的质量分数;(3)稀盐酸中溶质的质量分数。
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 样品质量 | 16g | 16 g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 61.6 g | 109.4g |
| 产生的CO2质量 | | |
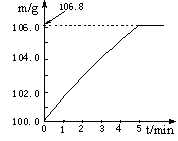
(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
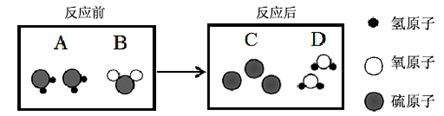
 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。